2015年,经济下行,科研经费总额缩减,科研圈里经过了“节衣缩食”的一年。虽然经费总额在缩减,但是新兴领域依旧方兴未艾,外泌体相关研究更是如火如荼,逐渐从小众走向大众,受到越来越多的关注,同时大量的商业圈人士也开始将目光投到外泌体领域,外泌体在临床诊断、治疗中的应用正在逐渐展开。2015年外泌体的突破进展囊括了外泌体性质、肿瘤、免疫、干细胞、心脑血管、损伤修复等多个领域。小编虽然才疏学浅,但还是斗胆班门弄斧,在这2015年的最后一天,为大家整理了2015年外泌体领域十大前沿进展,让我们一起回顾一下2015年突飞猛进的外泌体。
1. 体内成像证实外泌体体内传递的广泛性
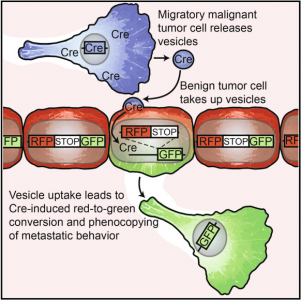
体外实验显示胞外膜泡(Evs:exosome、microvesicles 等)可以将有功能的mRNA传递给靶细胞从而改变靶细胞的行为。然而由于在体内无法辨别出是哪些细胞摄取了胞外膜泡(EVs),因此类似的体内实验无法进行。外泌体在体内作用的广泛程度一直是大家争论的一个焦点问题。
来自荷兰的Hubrecht研究所的研究者们利用携带 >loxP-Dsred-loxP>-GFP的转基因鼠以及可以表达Cre的肿瘤细胞制作了报告系统。 将该肿瘤细胞打入小鼠体内,肿瘤细胞分泌携带编码cre的mRNA的EVs被靶细胞吸收(转基因鼠的正常细胞),从而翻译出Cre酶用于切割loxP位点使靶细胞由红色标记转变为绿色标记。因此可以在体内条件下直观观测到靶细胞对EVs的摄取,以及EVs对靶细胞状态的改变。研究者们利用该系统发现,肿瘤(或正常)细胞分泌的EVs可以在全身水平上被其他肿瘤细胞或正常细胞摄取并改变靶细胞状态。从而证明了外泌体在体内传递的广泛性。
小编感言:外泌体重要么?传播广泛么?不用争论了,它可以影响全身啊。
【原文】Cell:In Vivo imaging reveals extracellular vesicle-mediated phenocopying of metastatic behavior.
2. 外泌体让癌中之王露出蛛丝马迹
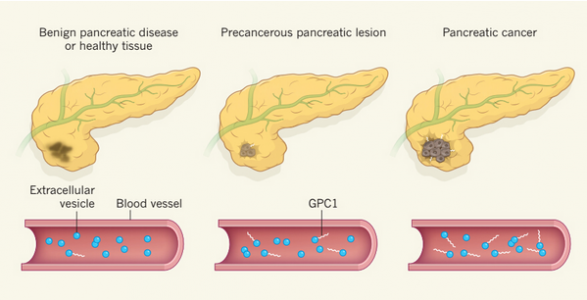
随着生活条件的改善和人口平均寿命的提升,癌症逐渐成为死亡的主要因素。由于胰腺在体内的位置相对隐蔽,目前的影像学检测很难对早期胰腺癌做出有效诊断。因此很多胰腺癌病人在确诊时已经发展到晚期,错过了最佳治疗时间。胰腺癌病人预后是所有癌症中最差的,因此,胰腺癌又被称作癌中之王。
来自美国M.D. Anderson Cancer Center研究者们通过大量的胰腺癌病人血清样本分析发现,相较正常人而言,胰腺癌病人血清中GPC1(glypican-1)阳性的exosome占比显著增高。进一步研究发现,GPC1阳性exosome在早期胰腺癌病人的血清中丰度就显著高于正常人群,这一发现为胰腺癌的前期诊断提供了十分重要的依据,为胰腺癌病人带来了福音,也可能会对胰腺癌的诊断带来颠覆性的改变。
小编感言:看!那不是正在襁褓中的癌中之王么!!!
【原文】Nature:Glypican-1 identifies cancer exosomes and detects early pancreatic cancer.
3. 外泌体——肿瘤小舟在茫茫大海中的灯塔
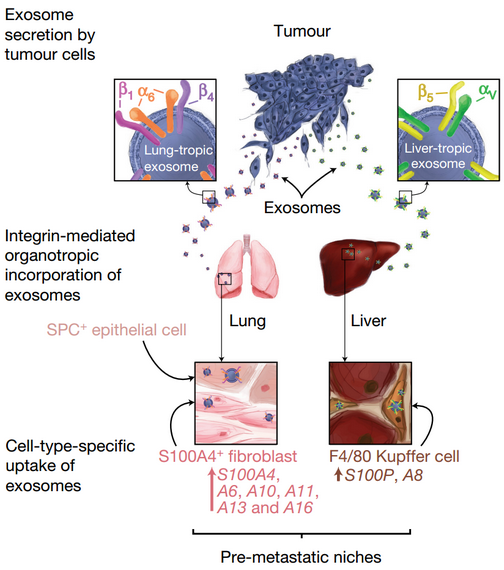
转移一直是困扰肿瘤治疗的最大问题。90%的肿瘤病人死于肿瘤转移或肿瘤转移的并发症,抑制转移才是治疗肿瘤的重中之重。肿瘤转移的器官倾向性依然是肿瘤学中一个待完善的领域。转移机制十分复杂,涉及到肿瘤细胞自身和肿瘤微环境等多种因素。
来自康奈尔大学的研究人员David Lyden等丰富了人们对肿瘤转移的认识。他们转移的肿瘤细胞在出发前会先行释放出外泌体,外泌体会到达预期转移的器官,被相应的细胞所摄取,改变这些靶细胞的状态,营造一个适宜转移来的肿瘤生长的微环境。在这其中,外泌体表面的整合素种类决定着靶器官的特异性,例如整合素α6β4和α6β1与肺转有关,而整合素αvβ5与肝转有关。这为抑制抑制肿瘤的转移提供了新的思路。
小编感言:用抗体封闭掉整合素。没了灯塔,肿瘤细胞,我看你还怎么转移!
【原文】Nature: Tumour exosome integrins determine organotropic metastasis.
4. 百年假说终印证,外泌体连接着“种子”和“土壤”
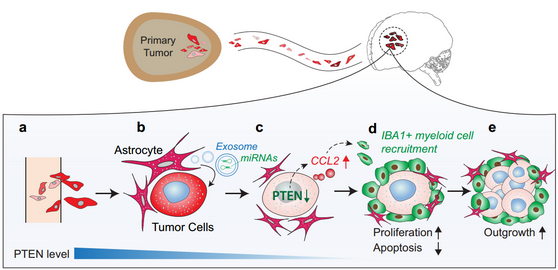
一百多年前,Stephen Paget经过多年的解剖学研究发现,特定的肿瘤细胞总是倾向于转移到特定的组织器官,并于1889年提出著名的“种子与土壤”转移假说,认为肿瘤细胞只能在适宜的组织器官环境中才能形成转移灶。由于当时技术限制,该假说并没有得以证明。随着技术的发展肿瘤的转移机制在不断被完善,人们发现肿瘤可以主动改变转移灶微环境,但微环境直接为肿瘤细胞提供便利的例子并不多见。
来自美国M.D. Anderson Cancer Center的Dihua Yu等发现正常表达PTEN的肿瘤细胞在脑部定植时,其PTEN的表达会降低,当从脑部重新分离出来后,其PTEN表达水平会恢复到之前水平。进一步研究发现肿瘤细胞转移到脑部后可以被神经胶质细胞分泌的外泌体所改造,其外泌体内部携带的大量的miRNA-19a可以靶向肿瘤细胞内的PTEN mRNA从而影响肿瘤细胞内PTEN的蛋白水平,通过这一途径进而影响CCL2和NF-kB等通路促进肿瘤细胞的增殖,提升肿瘤细胞的抗凋亡能力。这一发现,印证了百年前Paget的假说,脑部特定的微环境正是适宜肿瘤“种子”生长的“沃土”。
小编感言:原来百年前的科学家已经如此犀利的预想到了肿瘤转移的一些基本原理,可钦可佩啊!
【原文】Nature: Microenvironment-induced PTEN loss by exosomal microRNA primes brain metastasis outgrowth.
5. 外泌体——转移瘤掠夺资源的利器
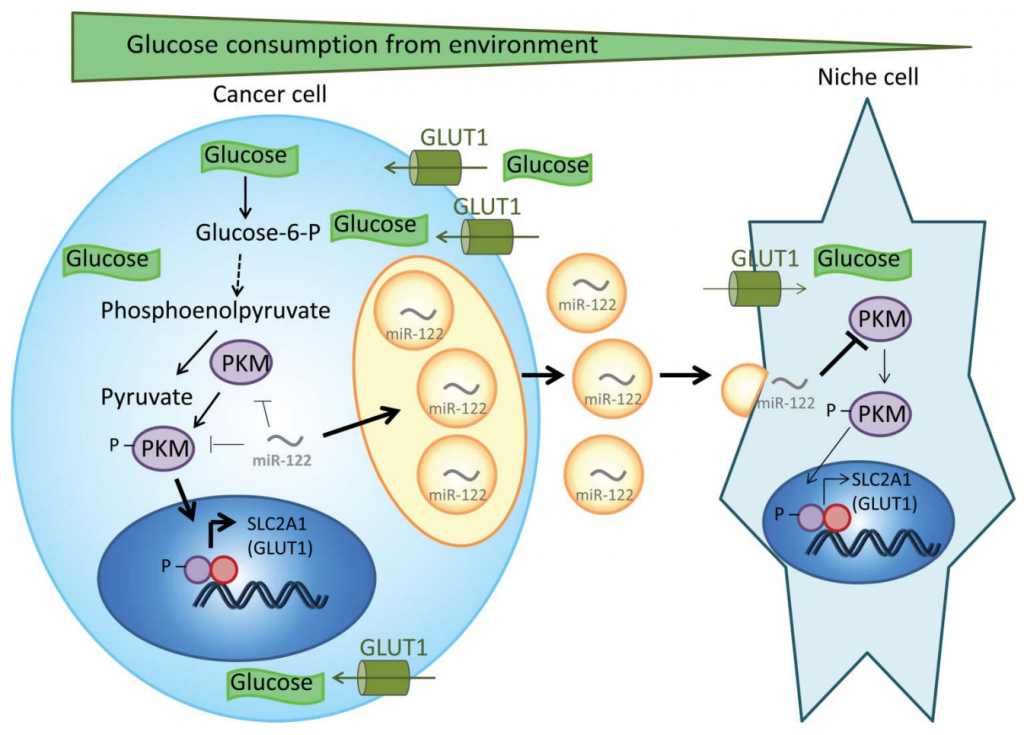
肿瘤代谢和转移前nich的形成都与肿瘤的转移过程有着千丝万缕的联系。近年来大家对代谢与转移的关系愈发关注。
来自City of Hope Beckman Research Institute的研究者们发现,癌细胞通过携带高水平miR-122的囊泡在转移前微环境中抑制非肿瘤细胞的葡萄糖摄取,为即将转移过去的肿瘤细胞提供一个高葡萄糖环境,来维持肿瘤细胞高水平的糖摄取。在体内,抑制miR-122可恢复远端器官包括脑和肺的葡萄糖摄取,并降低肿瘤转移的发生率。这暗示着肿瘤外泌体中miR-122可能是一个潜在的药物靶点。
小编感言:肿瘤细胞!打掉你的miR-122,看你再胡作非为!
【原文】Nature Cell Biology: Breast-cancer-secreted miR-122 reprograms glucose metabolism in premetastatic niche to promote metastasis.
6. 保护你的心脏——血浆外泌体的作用
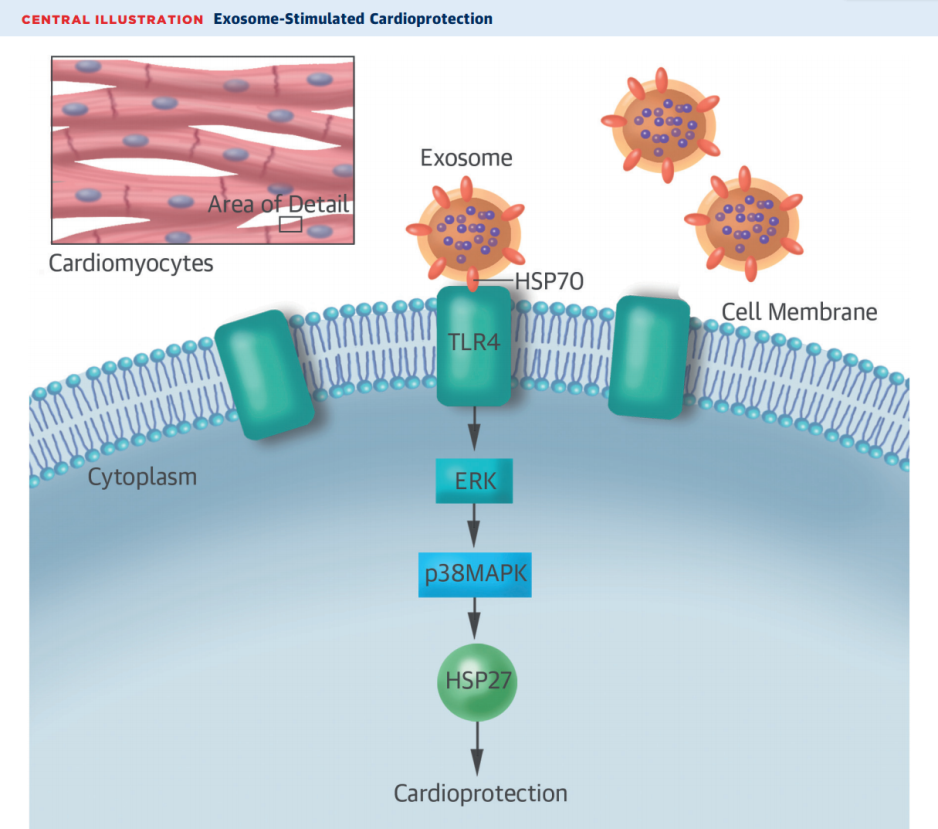
细胞释放外泌体到血液中,并将外泌体中的物质和信号传递到靶细胞。外泌体的心脏保护作用和信号通路激活的机制尚不清楚。内源性血浆外泌体可以传送信号到心脏并提供保护作用,防止缺血再灌注损伤。来自英国伦敦大学学院的研究者于4月份在J Am Coll Cardiol在线发表了外泌体的心脏保护作用的新证据。具体来说,大鼠心梗模型中,术前尾静脉注射外泌体,发现可以减少梗死面积。在注射外泌体后,梗死面积从48%降低到25%。该研究进一步证明,外泌体通过其膜表面上的热休克蛋白HSP70结合到受体细胞膜表面的toll样受体4(TLR4)上,从而介导了心脏保护的功能。受体细胞没有查明。 心肌梗死或局部缺血后HSP水平升高。其下游机制是通过ERK1/2磷酸化激活p38MAPK,最后使另一种热休克蛋白HSP27磷酸化。抗体中和HSP70可抑制心脏保护作用和ERK1/2和p38MAPK的磷酸化。
小编感言:心梗了怎么办?血液中的外泌体来保护!
【原文】Journal of the American College of Cardiology : Plasma exosomes protect the myocardium from ischemia-reperfusion injury.
7. 无所不包的外泌体——circular RNA也在里面
环状RNA(circRNA)是一类特殊的非编码RNA分子,也是RNA领域最新的研究热点。近期研究发现,circRNA在抑制miRNA功能,调节RNA聚合酶活性等方面发挥着作用,并且有数据显示circRNA可能直接参与调控一些重要的生物功能。 circRNA分子呈封闭环状结构,不易降解,稳定性远高于线性RNA分子,在体液中也可以稳定存在,circRNA中有很多高价值的潜在biomarker。
7月3日 Cell Research 在线发表了来自复旦大学上海医学院生物医学研究院的黄胜林研究员和上海交通大学医学院瑞金医院的何祥火研究员发现在外泌体里存在环状RNA,并且发现结直肠癌病人与正常人血清中exo-circRNA的差异。这一发现,刷新了人们对circRNA和外泌体的认知,将两个新兴领域联系在了一起,也进一步证明了circRNA和外泌体在生物体内的重要性。
小编感言:无所不包的外泌体啊!有什么是你没有的么?
【原文】Cell Research: Circular RNA is enriched and stable in exosomes: a promising biomarker for cancer diagnosis.
8. 心梗治疗的新方法——胚胎干细胞外泌体
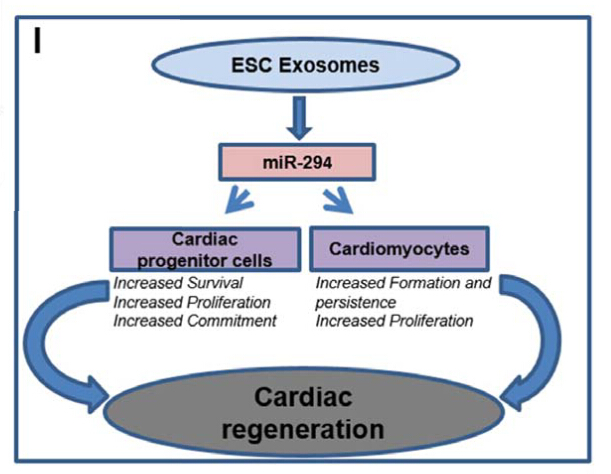
心血管领域权威杂志Circulation Research报道了胚胎干细胞来源的外泌体可以促进心梗后修复。该研究的体外实验发现小鼠胚胎干细胞来源的外泌体可减缓H9C2细胞对缺氧的死亡,减缓胚胎成纤维细胞对H2O2的死亡、促进HUVEC的成管。在体实验中,小鼠进行心梗手术后,在心梗边缘区注射外泌体,4周后心超、心梗面积等各项指标均明显改善。组织切片的免疫组化等检查证实外泌体可以促进血管新生(毛细血管密度)和心肌细胞增殖。此外,外泌体可促进心肌前体细胞的存活及增殖。基因芯片分析证实外泌体中含有差异表达的miRNA,其中miRNA290起重要作用。该研究首次证实胚胎干细胞在心梗治疗中的作用。
小编感言:干细胞治疗能否被外泌体替代?
【原文】Circulation Research: Embryonic Stem Cell-Derived Exosomes Promote Endogenous Repair Mechanisms and Enhance Cardiac Function Following Myocardial Infarction.
9. 高血压——外泌体是天使还是恶魔
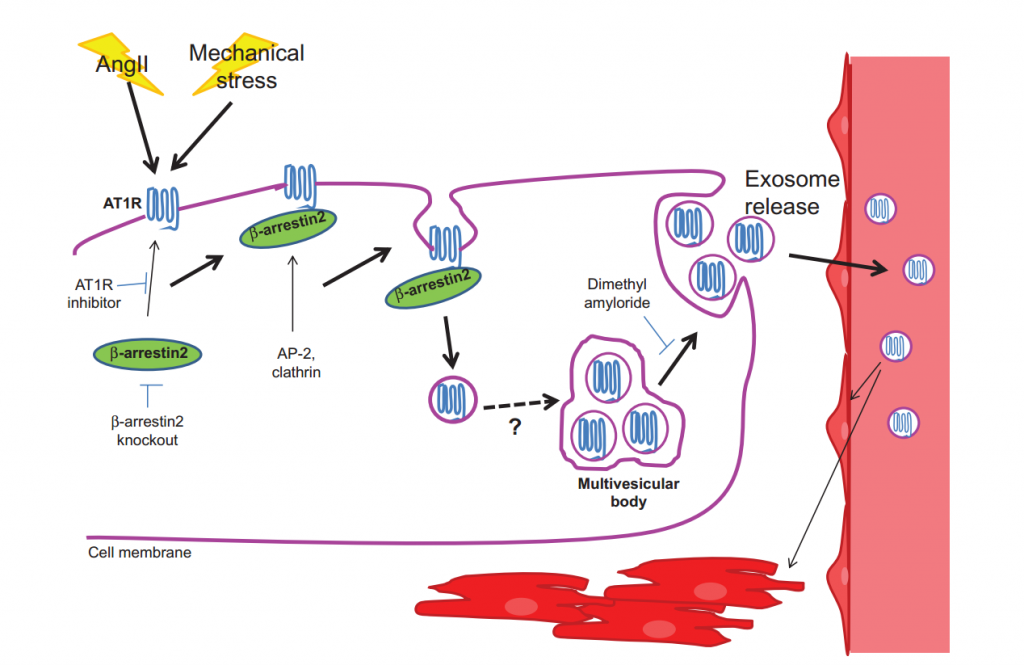
在心脏衰竭过程中,心肌血管紧张素Ⅱ的Ⅰ型受体(Angiotensin II Type I Receptor, AT1R)的丰度降低。该项表明,体外低渗机械拉伸和体内压力超负荷均可诱导的纳米尺寸的囊泡——外泌体分泌,该外泌体含有功能性AT1Rs可赋予受体细胞血管紧张素II刺激信号的接收能力。生物力学刺激后,AT1Rs在细胞内的运输和被分拣到外泌体上的过程需要多功能蛋白β-arrestin2的协助。体内注射含AT1R的外泌体可以恢复AT1受体基因敲除动物血管紧张素II引起的血压反应和心脏ERK信号。从循环外泌体获取AT1Rs的主要受体细胞包括:心脏和骨骼肌的肌细胞和阻力血管的内皮细胞和平滑肌细胞。β-arrestin2的条件敲除研究表明释放富含AT1R外泌体进入循环的细胞来源主要是心肌细胞。该研究第一次证明了心肌细胞在压力过载后释放富含AT1Rs的外泌体到循环中,作为细胞间通讯的方式之一,这种通讯不仅包括组织内的近距离传递,也包括不同组织器官间的远距离交流,在病理状态下,如高血压、心衰等,维持心血管的内稳态。心肌细胞分泌的含有血管活性受体的外泌体可能在血流动力学胁迫下具有降压的作用,从而起到了重要的稳态调节作用。在病理情况下,如压力超负荷,循环中富含AT1R的外泌体的释放是否对疾病发展具有重要作用还需要进一步的研究。
小编感言:当机体受到刺激,不仅激素,外泌体的分泌也会改变!
【原文】Circulation: Circulating Exosomes Induced by Cardiac Pressure Overload Contain Functional Angiotensin II Type 1 Receptors.
10. 外泌体——肿瘤免疫逃逸的帮凶
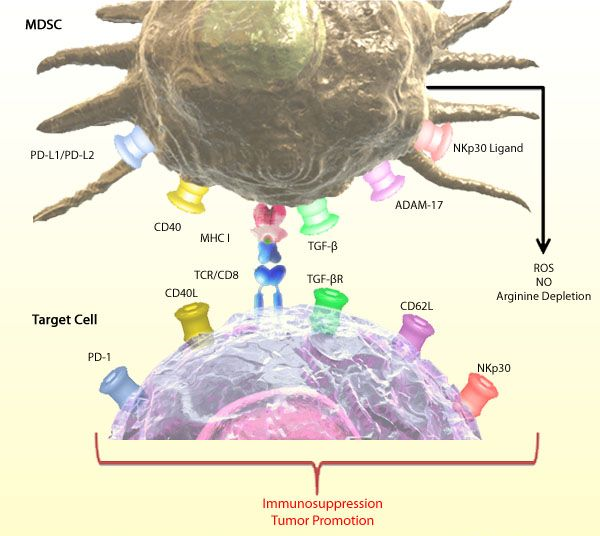
骨髓来源的抑制性细胞(Myeloid-derived suppressor cells,MDSCs)是骨髓来源的一群异质性细胞,是树突状细胞(dendritic cells,DCs)、巨噬细胞和(或)粒细胞的前体,具有显著抑制免疫细胞应答的能力。在长有肿瘤的小鼠和人体内这类细胞增多,并促进了肿瘤的生长。来自法国国家健康与医学研究院的研究人员们从小鼠细胞系培养上清中分离出肿瘤来源的外泌体(exosome)(tumor-derived exosomes, TDEs),并发现外泌体(exosome)上的HSP72通过激活STAT3抑制了MDSCs的免疫抑制作用。另外,肿瘤来源的可溶性分子通过Erk激发了MDSCs的扩增。外泌体(exosome)HSP72通过TLR2/MyD88依赖的方式诱导IL-6的自分泌,从而激活STAT3。更重要的是,在3个不同的小鼠肿瘤模型中使用dimethyl amilorid抑制外泌体(exosome)的分泌可增强化疗药物cyclophosphamide的抗肿瘤效果。人肿瘤细胞系来源的外泌体(exosome)可激活MDSCs,从而激发其Hsp72/TLR2依赖的免疫抑制作用。用amiloride(一种高血压治疗药物,也可以抑制外泌体(exosome)的形成)处理肿瘤病人来源的MDSCs可降低其免疫抑制作用。简言之,该工作发现肿瘤来源的外泌体(exosome)含有膜蛋白HSP72,促进MDSCs的免疫抑制功能,抑制了肿瘤的免疫监督。
小编感言:外泌体混淆视听,企图让肿瘤细胞逍遥法外!
【原文】Journal of Clinical Investigation: Membrane-associated Hsp72 from tumor-derived exosomes mediates STAT3-dependent immunosuppressive function of mouse and human myeloid-derived suppressor cells.
结语
大家可以看到2015年度外泌体领域的十大进展里主要集中在肿瘤转移、肿瘤免疫、诊断、心血管、干细胞方面。除此之外外泌体在除肿瘤外的免疫调节、靶向给药、组织损伤修复、基于芯片的外泌体快速检测、外泌体形成与分泌机制等方面都有研究发现。PubMed中统计数据显示,2015年度外泌体领域论文共1017项,较2014年767项增长32.6%。我们有理由相信2016年外泌体领域会有更多重要研究进展。
版权归外泌体资讯网所有,欢迎转载,但请注明出处和原文链接!
外泌体资讯网 2015年外泌体领域十大前沿进展





相信未来外泌体在科研以及诊断治疗领域内有更大是潜力!