外泌体中的DNA报道聊聊无几,而Cell Research主编貌似对外泌体DNA情有独钟。早在2014年,Cell Research发表的这篇研究Thakur, B. K., et al. (2014). "Double-stranded DNA in exosomes: a novel biomarker in cancer detection." Cell Res.报道了外泌体中的双链DNA是潜在癌症检测的新型标志物。Cell Research杂志的外泌体相关报道并没有很多,而每一篇报道都极具新意,另比如这篇,Li, Y., et al. (2015). "Circular RNA is enriched and stable in exosomes: a promising biomarker for cancer diagnosis." Cell Res.首次报道了外泌体中的环状RNA。
言归正传,外泌体的DNA有什么作用呢?来看最新报道吧。
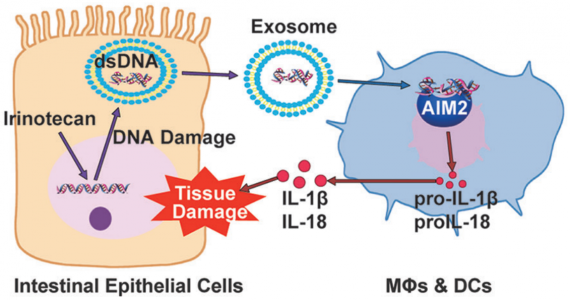
化疗通常会引起严重的胃肠道毒性,但潜在的机制仍不清楚。喜树碱类药物是细胞毒类药物的重要代表,也是当前临床使用最为广泛的一类细胞毒类药物,在肿瘤临床治疗中占有不可替代的重要地位。中科院上海药物所多年来致力喜树碱类药物的抗肿瘤新药研发,自主研发的喜树碱类候选新药希明替康目前正在进行临床Ib期研究。已经完成的临床Ia期试验显示,希明替康人体耐受性好、安全性高、低剂量显效、安全窗口广,显示出极富潜质的应用前景。然而,与其它的细胞毒类药物一样,喜树碱类药物严重的毒性问题极大地制约了其临床应用。其中,迟发性腹泻是喜树碱类药物最严重的毒性反应,临床发生率高达40%,且个体差异大,严重者可致患者死亡。一直以来,因机制不明,目前在临床上仅能在腹泻发生之后采用对症治疗的手段,收效甚微,严重制约药物临床获益。
针对上述问题,中科院上海药物所肿瘤药理团队耿美玉研究员课题组与上海生命科学研究院孙兵研究员课题组合作在最新一期的Cell Research上发表文章,采用广泛应用的细胞毒素伊立替康(irinotecan, CPT-11)作为代表性药物,报道了该治疗诱导了肠道中双链DNA的大规模释放,导致了该化合物的剂量依赖性肠毒性。具体来说,通过外泌体分泌释放的“self-DNA”进入先天免疫细胞的细胞溶质并激活AIM2(黑素瘤2中不存在)炎性细胞。这导致成熟的IL-1β和IL-18分泌并诱导肠粘膜炎和迟发性腹泻。有趣的是,在AIM2缺陷小鼠或药理学抑制剂如沙利度胺(thalidomide)中,AIM2信号传导的消除显着降低了药物诱发性腹泻的发生率,而不影响CPT-11的抗癌效能。这些发现为化疗如何触发引起肠道毒性的先天性免疫反应提供了具体机制,基于该机制,研究采用临床样本证实dsDNA是喜树碱类药物的毒性标志物,并揭示了维持抗肿瘤作用但避免相关不良炎症反应的新化疗方案。
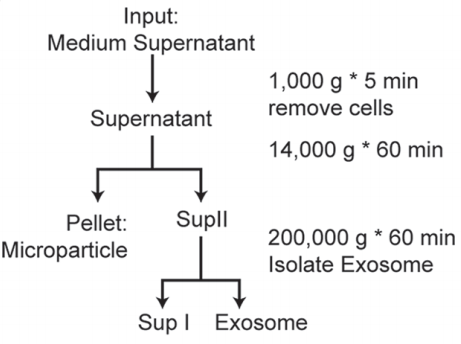
该研究的外泌体提取方法
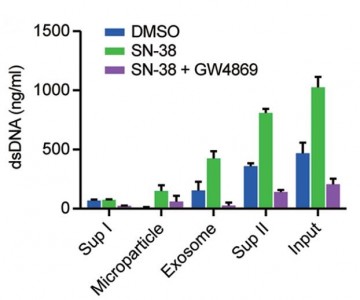
细胞外的双链DNA主要存在于外泌体中
部分内容来源于药物所
参考文献:
Chemotherapy-induced intestinal inflammatory responses are mediated by exosome secretion of double-strand DNA via AIM2 inflammasome activation. Cell Res. 2017 Apr 14. doi: 10.1038/cr.2017.54. [Epub ahead of print]





