外泌体资讯网 2016年12月30日 讯/ 2016年的科研圈内,外泌体无疑是一颗闪耀的新星,在经济停滞、经费缩减的全球大背景下外泌体等新兴领域的研究却是一路高歌,如火如荼。诸如外泌体等囊泡的作用范围、功能作用等被接连报道,这使得外泌体作为细胞间通讯的“桥梁”被大众广为认识。回顾2016年,随着研究的不断深入,外泌体领域呈现出了相对清晰的格局,目前外泌体研究主要集中在细胞通讯介导细胞行为、生物标志物筛选、药物载体研发三大方向。在2016年最后的几天,外泌体之家运营团队虽然才疏学浅,但还是斗胆班门弄斧为大家整理了2016年外泌体领域十大前沿进展(排名不分先后),希望借此拾遗补艺,为大家做一个年终总结,希望能够抛砖引玉,引起大家的讨论。
1. Nature Nanotechnology:纳米级侧向位移微流控芯片可分离检测低至20纳米的外泌体
确定性侧向位移(Deterministic lateral displacement,DLD)柱形微流控芯片是一种有效的检测分析和分离富集微米级颗粒的技术,包括血液中的寄生虫、细菌、血细胞和循环肿瘤细胞等。然而,这种技术在此前还没有应用到真正的纳米级,如能达到纳米级后就可用于分析生物胶体,比如外泌体等。
来自IBM、普林斯顿大学与西奈山伊坎医学院的科学家们合作利用可制造的硅工艺生产纳米级DLD(nano-DLD)芯片,产生均匀的间隙尺寸,其范围从25到235纳米。他们发现,在低Péclet (Pe)数情况下,扩散和确定性位移产生竞争时,nano-DLD芯片仍然可以灵敏地将20-110纳米的颗粒分开。 这项发表在Nature Nanotechnology(IF=35.267)的研究价值在于,该技术可以分离纳米级的生物颗粒,这比以前的分离技术小了50倍。这个前所未有的捕获能力可以使得医生们更容易地来分析纳米级的生物颗粒,如DNA、病毒和外泌体。而这些微粒,正是疾病(比如癌症)病症初期就能显现的迹象,这样在症状出现之前发现病症,将会得到更好的治疗。
参考文献:Wunsch, B. H., et al. (2016). "Nanoscale lateral displacement arrays for the separation of exosomes and colloids down to 20 nm." Nat Nano advance online publication. IF=35.267
相关链接:Nature Nanotech:纳米级侧向位移微流控芯片可分离检测低至20纳米的外泌体
福布斯杂志Brandvoice:Nature一作讲述IBM科幻级早期癌症外泌体检测芯片的发现历程
2. Cell:细菌胞外膜泡传递LPS至宿主细胞浆内产生免疫反应
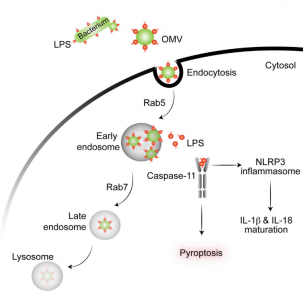
先天性免疫对各种入侵的病原微生物能快速反应,同时在特异性免疫的启动和效应过程也起着重要作用。革兰氏阴性细菌会分泌直径为20-250纳米的胞外膜泡(outer membrane vesicles, OMVs)。胞外膜泡并不是细菌细胞壁损坏或裂解产生的副产品,而是细胞程序性产生的真正的分泌膜泡。胞外膜泡会促进病原微生物和宿主间的交流,并且脂多糖LPS是胞外膜泡最丰富的组成部分之一。胞质溶胶中的脂多糖(LPS)可激活caspase-11,并且对宿主防御革兰氏阴性细菌感染和败血症的发病极为重要。但是,能激活caspase-11的大多数革兰氏阴性细菌并不能进入胞质中。
来自康涅狄格大学的研究人员发现革兰氏阴性细菌产生的细胞外膜泡可作为载体递送LPS进入宿主细胞质,在体外和体内实验中触发caspase-11依赖性免疫反应。胞外膜泡通过内吞作用进入宿主细胞质,LPS从早期胞内体释放进入细胞质。利用胞外膜泡生成能力被严重削弱的细菌突变体,揭示了胞外膜泡在介导LPS到胞质的重要性。该研究结果表明胞外膜泡在革兰氏阴性细菌感染过程中传递LPS至宿主胞质然后活化caspase-11的关键作用。
参考文献:Vanaja S K, Russo A J, Behl B, et al. Bacterial Outer Membrane Vesicles Mediate Cytosolic Localization of LPS and Caspase-11 Activation[J]. Cell, 2016.
相关链接:Cell:细菌胞外膜泡传递LPS至宿主细胞浆内产生免疫反应
3. Cell:布氏锥虫通过细胞外膜泡传递毒力因子引起宿主贫血症
动质体(Kinetoplastid)是一种附有鞭毛的原生动物,包含某些能使人类或其他动物发生严重疾病的寄生虫,如非洲昏睡病(布氏锥虫)、南美锥虫病(克氏锥虫)等。像许多细胞外的病原体一样,非洲锥虫感染最初引起包括炎症细胞因子的表达和骨髓细胞的活化在内的Ⅰ型免疫应答。这些宿主的免疫反应可解释锥虫病相关的贫血的病理,但引起红细胞清除的寄生虫因素在此之前并不清楚。
来自美国佐治亚大学的研究人员揭示了锥虫鞭毛膜出芽形成动态膜纳米管并形成细胞外囊泡。这些细胞外囊泡的蛋白质富含特定的鞭毛膜蛋白,并包含了一些与宿主体内的发挥毒力和抗性作用相关的蛋白质。该研究结果发现,细胞外囊泡导致了非洲锥虫病的复杂性,细胞外囊泡可在寄生虫之间和易被忽视的与宿主细胞之间传输毒力因子。这项研究工作揭示了非洲锥虫病的发病重要机制,为该疾病的治疗提供了新思路。
参考文献:Szempruch, A. J., et al. (2016). "Extracellular Vesicles from Trypanosoma brucei Mediate Virulence Factor Transfer and Cause Host Anemia." Cell 164(1-2): 246-257.
相关链接:Cell:布氏锥虫通过细胞外膜泡传递毒力因子引起宿主贫血症
4. Cancer Cell:外泌体中具有传递肿瘤抗药性功能的lncRNA
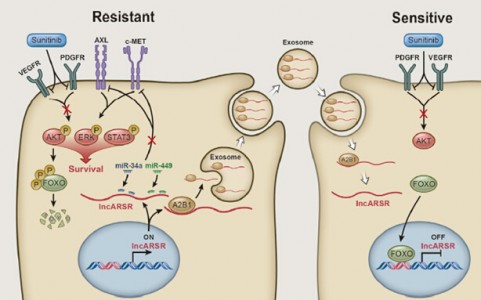
肿瘤抗药性一直是一个困扰肿瘤治疗的问题。随着研究的深入,研究者发现外泌体在肿瘤抗药性过程中发挥着重要功能,外泌体通常可以从抗药性肿瘤细胞通过传递miRNA来赋予药物敏感性受体肿瘤细胞抗药性。lncRNA是近些年新兴的一个领域,随着研究的发展,越来越多的发挥内源性竞争RNA功能的lncRNA被发现。
舒尼替尼耐药是晚期肾细胞癌(RCC)治疗的一个难点。来自第二军医大学王林辉、王红阳等研究组的研究人员确定了一个与舒尼替尼抵抗相关的lncRNA(命名为lncARSR)。在RCC细胞中,lncARSR通过竞争性结合miR-34/miR-449来促进AXL和c-Met表达而赋予细胞舒尼替尼抗性。此外,具有生物活性的lncARSR可以被纳入外泌体并被传输到舒尼替尼敏感性RCC细胞,从而传播舒尼替尼抗性。对舒尼替尼抗药性RCC施加舒尼替尼的同时靶向关闭lncARAR或同时施加AXL/c-MET抑制剂可以有效缓解肿瘤细胞对舒尼替尼抵抗。因此,lncARSR可以用作预测和治疗舒尼替尼耐药的潜在治疗靶标。
参考文献:Qu L et al. Exosome-Transmitted lncARSR Promotes Sunitinib Resistance in Renal Cancer by Acting as a Competing Endogenous RNA. Cancer Cell. 2016 May 9;29(5):653-68.
相关链接:快讯-Cancer Cell:王林辉、王红阳等发现外泌体中具有传递肿瘤抗药性功能的lncRNA
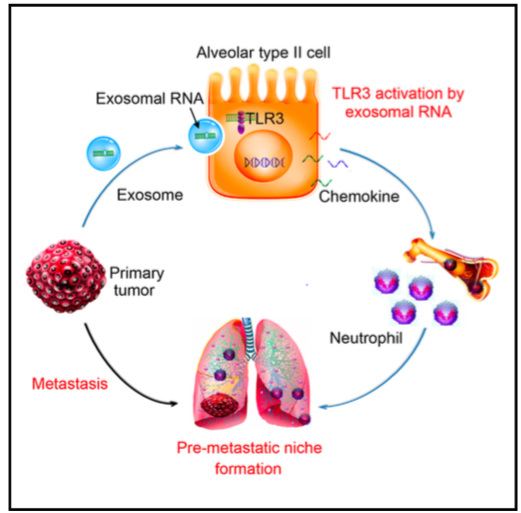
5. Cancer Cell:肿瘤外泌体促进肺促转移龛结构形成新机制
癌细胞传播到远处器官部位并适应新环境是转移的首要原因。原发肿瘤可以促进新位置的肿瘤微环境的形成,这种由基质细胞组成特定结构通常被人们称为促转移“龛”结构 (pre-metastatic niche),但是在此之前原发肿瘤对促进促转移“龛”结构的形成机制并不完全清楚。
来自第二军医大学曹雪涛研究团队发现,肺上皮细胞是中性粒细胞募集和肺促转移“龛”结构形成的关键位置,这是通过肿瘤外泌体RNA和Toll样受体3(TLR3)实现的。 TLR3缺陷小鼠在自发性转移模型中表现出肺转移的降低。原发肿瘤产生的外泌体RNA,主要是小的核内RNA(snRNA),在肺上皮细胞中激活TLR3,从而诱导肺中趋化因子的分泌以及中性粒细胞的募集。该研究团队的这一发现,揭示了肿瘤外泌体RNA和宿主肺上皮细胞的TLR3活化这条转移路径,这将为肿瘤肺转移提供了新的潜在治疗靶点。
参考文献:Liu et al.Tumor Exosomal RNAs Promote Lung Pre-metastatic Niche Formation by Activating Alveolar Epithelial TLR3 to Recruit Neutrophils. 2016, Cancer Cell 30, 243–256.
相关链接:曹雪涛研究团队揭示肿瘤外泌体促进肺促转移“龛”结构形成新机制
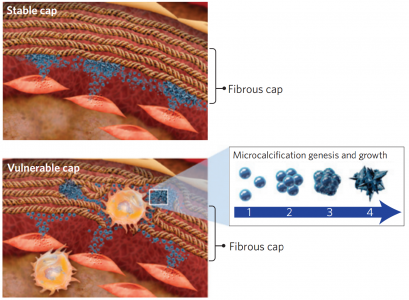
6. Nature Materials: 细胞外膜泡介导动脉粥样硬化斑块中微钙化的发生
临床证据显示动脉钙化与心血管疾病有相关性。动脉粥样硬化斑块内的应力分布的有限元建模分析显示,纤维帽的亚细胞微钙化可促进斑块的材料失效,但大的钙化可以稳定它。然而,动脉粥样硬化过程中矿物形成和生长的物理化学机制在此前尚不清楚。
来自哈佛医学院的研究人员通过使用三维胶原凝胶,模仿动脉粥样硬化的纤维帽的结构特征,用高分辨率显微和光谱分析水凝胶和人的钙化斑块,结果表明,钙化矿物形成和成熟与钙化细胞外囊泡的聚集、微钙化的形成和最终大钙化等一系列的事件有关。钙化形态和斑块的胶原蛋白含量两因素与动脉粥样硬化斑块的稳定性是相互关联的。
参考文献:Hutcheson JD et al. Genesis and growth of extracellular-vesicle-derived microcalcification in atherosclerotic plaques. Nat Mater. 2016 Mar;15(3):335-43.
相关链接:Nature materials: 细胞外膜泡介导动脉粥样硬化斑块中微钙化的发生和发展
7. Nature:巨噬细胞微囊泡影响炎症发生
专职吞噬细胞(如巨噬细胞)和非专职吞噬细胞(如上皮细胞)每天会清除数以十亿计的凋亡的细胞和碎片。虽然专职吞噬细胞和非专职吞噬细胞绝大多数情况下都离组织很近,但是他们在清除凋亡细胞的过程中是否有相互间的信息交流,这些交流过程又会怎样影响炎症反应此前还不清楚。
来自美国弗吉尼亚大学的研究人员发现,巨噬细胞会通过释放可溶性生长因子(即IGF-1)和微囊泡来改变非专职吞噬细胞和颗粒的类型以及对炎症的反应。在吞噬凋亡细胞或响应炎症因子时,巨噬细胞会释放IGF-1。IGF-1会结合到非专职吞噬细胞表面的受体上,调节他们的吞噬作用,降低对大体积凋亡细胞的吞噬,增强对微囊泡的吞噬,同时不改变巨噬细胞的吞噬特性。巨噬细胞也会释放微囊泡,这些微囊泡会被上皮细胞等非专职吞噬细胞吞噬,从而降低炎症反应。呼吸道上皮细胞表面IGF-1受体的缺失,会加重过敏原引起的肺部炎症。该研究揭示了IGF-1及微囊泡依赖的巨噬细胞和上皮细胞的通信会影响组织炎症。
参考文献:Han CZ et al. Macrophages redirect phagocytosis by non-professional phagocytes and influence inflammation. Nature. 2016 Nov 7.
相关链接:Nature:巨噬细胞微囊泡影响炎症发生
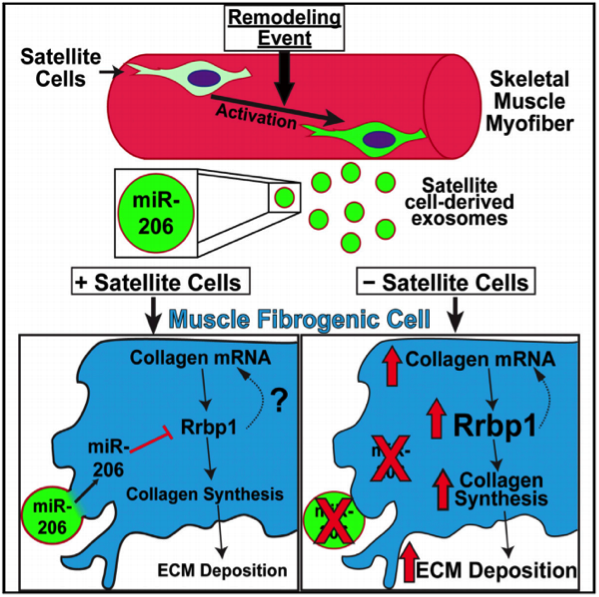
8. Cell Stem Cell:骨骼肌肌源性祖细胞通过外泌体发挥重要作用
在生长和修复期间,肌肉干细胞(称为卫星细胞)和骨骼肌中的细胞外基质(ECM)之间的相互作用对于肌肉适应是至关重要的。卫星细胞是成体骨骼肌中的主要干细胞群体,可被肥大性刺激激活,并在围绕肌纤维的细胞外基质(ECM)内产生肌原性祖细胞(MPC)。该ECM主要由间质纤维形成细胞分泌的胶原组成,在肥大和老化期间影响卫星细胞活性和肌肉修复。
来自美国肯塔基大学的研究人员阐明了MPCs与间质纤维形成细胞之间的相互作用,可在肥大性刺激过程中确保适当的ECM沉积和最佳的肌肉重塑。在生长刺激的第一周期间,MPC依赖的ECM重塑足以使得长期的肌纤维肥大。MPCs分泌含有miR-206的外泌体,可抑制纤维形成细胞中胶原合成的主要调节剂Rrbp1,以防止ECM的过度沉积。这些研究结果揭示了骨骼干/祖细胞与其他细胞类型相互作用调节细胞外环境以保障组织维持和适应。
参考文献:Fry, C. S. et al. (2016). "Myogenic Progenitor Cells Control Extracellular Matrix Production by Fibroblasts during Skeletal Muscle Hypertrophy." Cell Stem Cell. IF=22.387
相关链接:Cell Stem Cell:你健身吗?你增肌吗?骨骼肌肌源性祖细胞通过外泌体在其中发挥重要作用
9. Science:细胞外膜泡和肠道菌群共同调节炎症性肠病
肠道菌群时下已成为科研热点之一。炎症性肠病(IBD)与人类基因组的危险变异和肠道菌群失调密切相关。研究发现,这些与人类共生的脆弱拟杆菌通过外膜囊泡(OMVs)的分泌传递免疫调节分子提供给免疫细胞。来自加州理工大学生物工程学系的Sarkis K.Mazmanian博士研究组在Science上发表文章,揭示OMVs的作用机制与IBD相关基因(ATG16L1和NOD2)密切相关,在结肠炎过程中激活非经典的自噬途径发挥保护作用。 ATG16L1缺陷的树突状细胞不能诱导调节性T细胞以抑制粘膜炎症。携带ATG16L1重大风险变异的受试者的免疫细胞在OMV对T-reg反应缺陷。该研究发现,易感基因多态性在“感应”来自微生物的保护信号方面有缺陷从而促进了疾病的发生发展,为炎症性肠病(IBD)定义了一个潜在的关键基因与环境相互作用的病因学。
参考文献:Chu, H., et al.(2016). "Gene-microbiota interactions contribute to the pathogenesis ofinflammatory bowel disease." Science 352(6289): 1116-1120.
相关链接:Science:细胞外膜泡和肠道菌群共同调节炎症性肠病
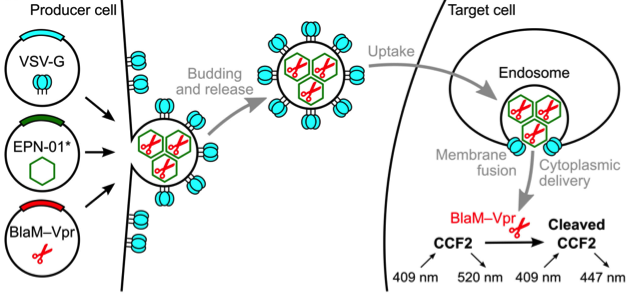
10. Nature:一种独特的蛋白设计可诱导包含蛋白纳米笼的细胞外膜泡的形成
复杂的生物过程通常通过多类大分子自组装而成的纳米结构进行,例如核糖体或包膜病毒。针对核酸或蛋白质的自组装结构设计已经开发出了很多方法,但是用于工程化杂交生物材料的策略才开始出现。来自美国犹他大学的研究人员在Nature上发表文章报道了自组装蛋白质纳米笼(nanocages)的设计,它们以一种类似于一些病毒的方式从人类细胞释放到小囊泡中。研究人员将这种生物材料称为“包膜蛋白纳米笼”(EPNs),并阐述了蛋白质是如何被编程以指导杂交生物材料的形成,并执行复杂的任务,建立EPNs作为一类设计的、模块化的,遗传编码的纳米材料,可以在细胞之间转移分子。该方法在药物递送方面有很重要的应用前景。
参考文献:Votteler, J., et al. (2016). "Designed proteins induce the formation of nanocage-containing extracellular vesicles." Nature 540(7632): 292-295. IF=38.138
相关链接:Nature:一种独特的蛋白设计可诱导包含蛋白纳米笼(nanocages)的细胞外膜泡的形成
2016年外泌体的研究呈现出新的特点,随着诸如外泌体影响范围是局部的还是系统的,外泌体是否具有调控生物学过程的功能等基础问题的解决,今年的进展主要集中在外泌体功能的解读方面。应用性的外泌体相关技术进展也不可忽视,外泌体诊断试剂盒的上市为外泌体未来的应用提供了想象空间。外泌体功能愈发清晰也为未来寻找新型药物靶点提供了前期的知识积累。外泌体作为药物载体的研究进展在今年尤为显著,无论从文章数量及质量上都相较去年有长足进步。相较去年完全的基础性研究,今年外泌体领域的进展已经开始走向应用领域。作为液体活检的一个分支,外泌体给诊断市场带来了新的想象空间。
目前依旧有一些问题是我们需要关注的,外泌体分离纯化的手段还不统一,这影响到了外泌体研究成果的可重复性;体液外泌体分离方法依旧不成熟,亟待简便高效的方法出现;外泌体进入受体细胞后的命运还不十分清楚等。随着研究的进一步深入,相信这些问题都会逐渐被解决,我们有理由相信作为细胞间通信的重要“桥梁”的外泌体在未来会有更广阔的发展空间。(exosomemed.com)
版权归属外泌体资讯网及外泌体之家所有,欢迎转载,但请注明出处及原文链接!
外泌体资讯网 【年终盘点】2016年外泌体领域十大前沿进展