小细胞外囊泡(sEV)是直径在30~150 nm的脂质双分子层囊泡,携带亲代细胞的分子特征,包括表面蛋白、核酸、脂质等,在细胞间通讯和疾病进展中发挥重要作用。sEV表面蛋白与受体细胞相互作用,诱导生理变化,促进癌症进展和肿瘤转移。众多肿瘤相关蛋白在sEV表面被发现,其类型和表达水平与特定癌症的发生和进展密切相关,且sEV在体液中稳定性高,逐渐成为有前景的非侵入性癌症筛查标志物。当前sEV表面蛋白的检测方法,包括纳米流式细胞术、纳米颗粒跟踪分析仪、western blot、蛋白质谱等,普遍依赖昂贵的分析设备和繁琐的分离纯化流程,极大地限制了快速便携式癌症筛查的应用范围。
近日,中山大学戴宗教授团队在Nano Letters杂志上发表题为“A Tyndall Effect-Based Visible Aptasensing Platform Enables Sensitive and Isolation-Free Profiling of Small Extracellular Vesicle Surface Proteins”的论文,主要介绍了一种基于丁达尔效应的可视化核酸适体传感平台(TEVAP),用于低成本、灵敏且无需分离复杂生物样本中sEV表面蛋白的直接检测。通过将巯基修饰的核酸适体与金纳米颗粒(AuNPs)共价结合构建核酸适体传感器(Apt /AuNPs),利用核酸适体与sEV表面蛋白的特异性结合,引发AuNPs聚集,增强散射信号,实现sEV表面蛋白的检测(图1)。第一作者为川北医学院附属医院张浪博士,通讯作者为中山大学韩兴助理教授、张艳飞博士以及香港理工大学殷文博士。
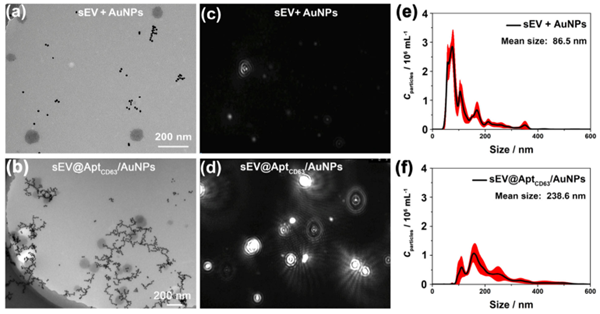
研究中首先评估了TEVAP对不同粒径AuNPs的响应,发现随着AuNPs粒径的增加,丁达尔效应信号增强。通过透射电子显微镜(TEM)和纳米粒径跟踪分析(NTA)验证了AuNPs与sEV的结合及聚集情况。以人肝癌细胞(HepG2)来源的sEV为模型验证TEVAP策略的可行性(图2),发现AptCD63/AuNPs与sEV孵育后丁达尔效应信号显著增强,且非特异性聚集较少。进一步优化了TEVAP的粒径、浓度和孵育时间等条件,确定了最佳检测条件,并评估了TEVAP对sEV浓度的定量关系,检测限低至6.5×106颗粒/mL。
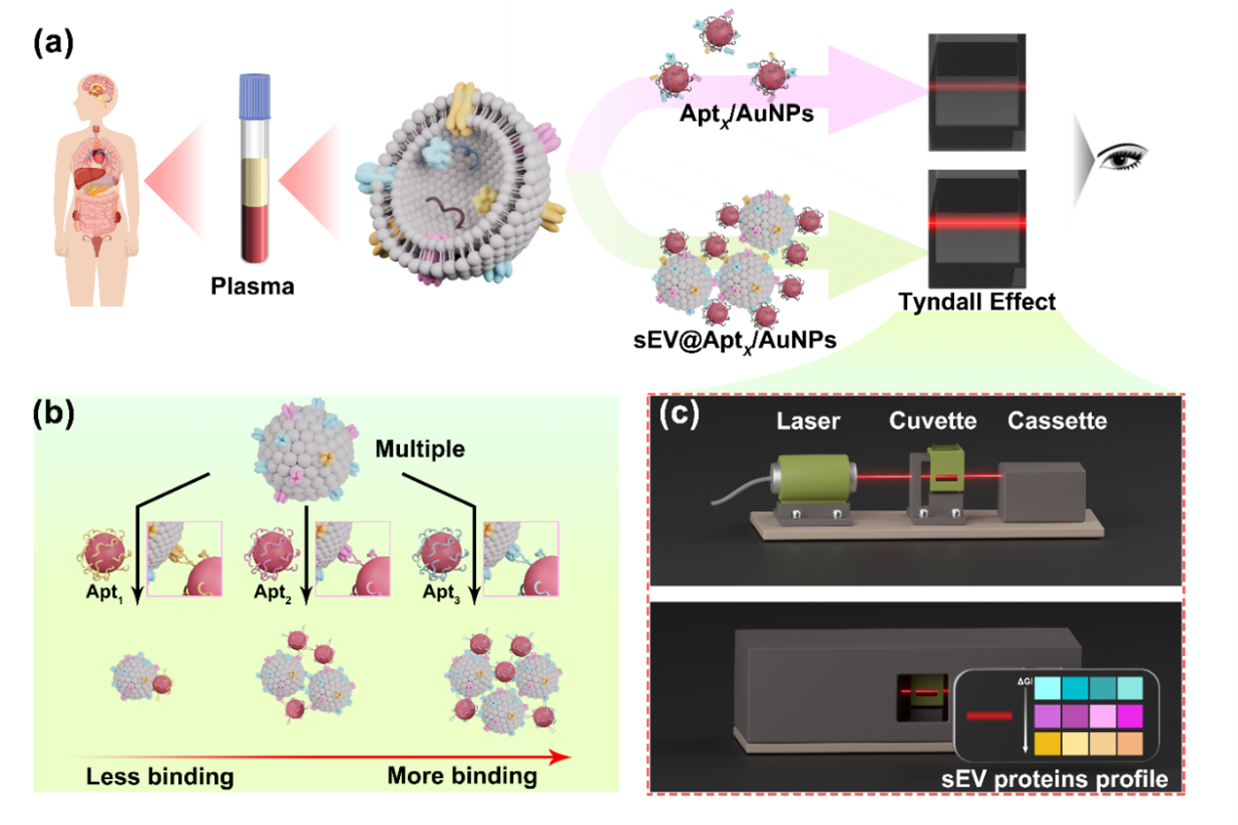
图1. TEVAP检测sEV蛋白表型的示意图
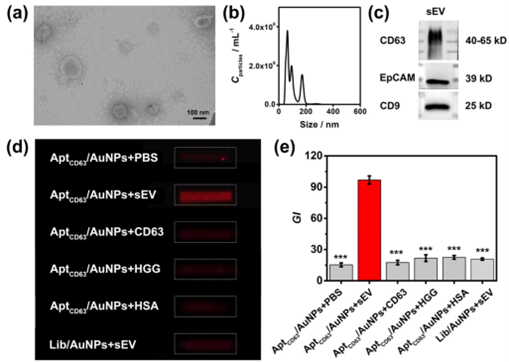
图2. sEV表征以及TEVAP检测其表型的可行性研究结果
进一步通过TEM和NTA综合验证了丁达尔效应的信号增强来自于sEV表面蛋白引发AuNPs聚集形成大颗粒复合物,尺寸显著增大(图3)。
图3. TEM和NTA验证丁达尔效应增强的原理
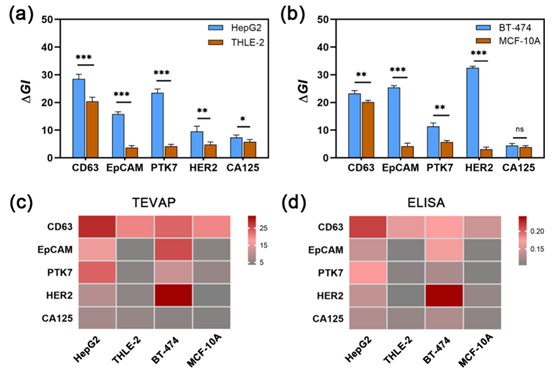
体外检测模型和多靶标检测能力验证:使用肝癌、乳腺癌,以及对应的正常细胞来源的sEV作为模型,将CD63、EpCAM、PTK7、HER2和CA125这五个潜在sEV生物标志物作为检测目标,构建核酸适体传感器面板(图4)。在细胞培养上清液分析中,TEVAP能显著区分恶性上皮细胞和非恶性上皮细胞来源的sEV表面蛋白表达,实现了对肝癌和乳腺癌相关sEV表面蛋白的多重检测,且检测结果与ELISA一致,证实了TEVAP的准确性。
图4. TEVAP用于肝癌和乳腺癌细胞sEV表面蛋白的多重检测
临床样本检测:最后对32份临床样本(包括10例肝癌患者、10例乳腺癌患者和12名健康志愿者的血浆)进行检测(图5),TEVAP成功区分肝癌和乳腺癌患者与健康对照组,具有较高的敏感性(肝癌100%、乳腺癌90%)和特异性(均为100%)。通过ROC曲线分析,结合多种表面蛋白水平的无权重总和,对肝癌和乳腺癌的诊断准确性高于单一蛋白。
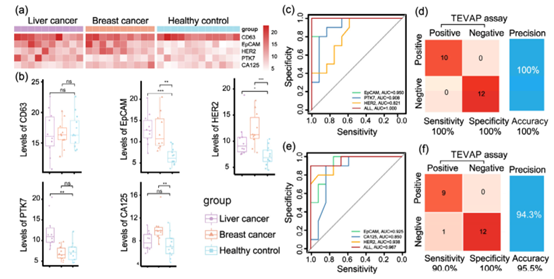
图5. TEVAP检测肝癌和乳腺癌临床样本
参考文献:
A Tyndall Effect-Based Visible Aptasensing Platform Enables Sensitive and Isolation-Free Profiling of Small Extracellular Vesicle Surface Proteins, Nano Lett. 2025 Jun 24. doi: 10.1021/acs.nanolett.5c01413.
外泌体资讯网 Nano Letters |中山大学 戴宗教授团队:基于丁达尔效应的适配体传感平台用于小细胞外囊泡表面蛋白分析