在睾丸微环境的协调作用下,精原干细胞 (Spermatogonial stem cells, SSCs) 的自我更新和分化之间的平衡被有效维持,确保稳定的干细胞储备和强大的精子生成。在这个环境中,细胞外囊泡,特别是外泌体(Exosome),已成为细胞间通讯的关键载体。尽管它们的重要性得到了认可,但睾丸外泌体在调节SSCs命运方面的影响仍未完全表征。各种研究表明睾丸微环境中,支持细胞(Sertoli cells, SCs)在维持精原干细胞自我更新和分化中发挥着至关重要的作用,其功能异常可能导致睾丸疾病的发生和发展。近日, 南京农业大学动物科技学院邹康教授团队在J Cell Physiol上发表题为“Regulation of spermatogonial stem cell differentiation by Sertoli cells-derived exosomes through paracrine and autocrine signaling”的研究论文(doi: 10.1002/jcp.31202),证明了支持细胞(SCs)来源的外泌体(SC-EXOs)可通过自分泌调节GDNF表达来影响SSCs分化。
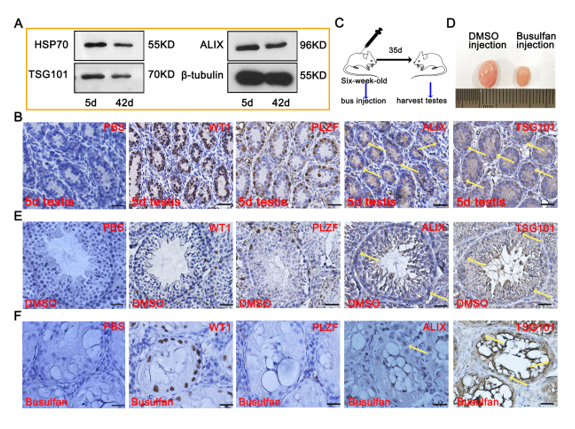
该研究基于这样的假设:SCs分泌的外泌体参与精原干细胞发育的关键时期。研究发现,SSCs摄取SC-EXOs后PLZF、MVH和STRA8表达上升,ID4和GFRA1水平下降。有趣的是,在SC-SSC共培养系统中阻碍外泌体分泌后减弱了SSCs分化,表明SC-EXOs可能通过旁分泌信号调节这一过程。进一步的研究揭示了SC-EXOs中miR-493-5p的存在,通过抑制SCs中的Gdnf mRNA间接抑制SSCs分化,表明SC-EXOs可通过自分泌调节GDNF表达来影响SSCs分化。总之,研究阐明了SC-EXOs如何影响SSCs分化的复杂调节机制,提供了新的视角,并为未来的临床前和临床研究奠定了基础。首先为了证明睾丸微环境中存在外泌体,作者构建了生殖细胞耗竭的睾丸模型(图1C),发现生殖细胞丢失后睾丸微环境仍然表达外泌体特异性标志物,证明精原干细胞微环境中存在外泌体。随后分离得到支持细胞,通过电镜、NTA、免疫荧光证明支持细胞可以分泌体(图2)。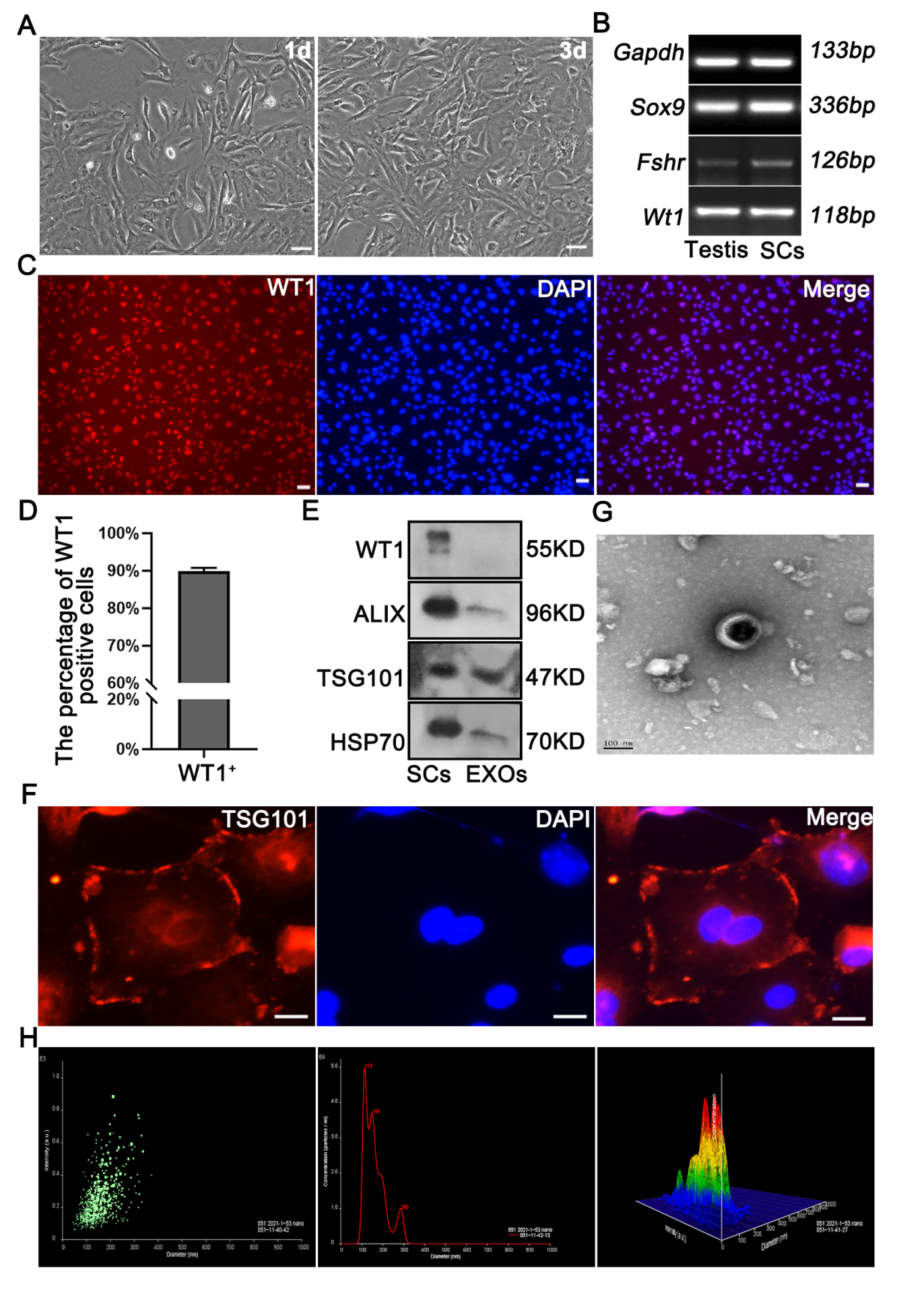
随后作者将精原干细胞暴露于SC-EXOs时,观察到了明显的分化相关基因的表达上调,这些基因包括PLZF、MVH和STRA8等,而ID4和GFRA1的表达则被抑制。这些基因的表达变化表明,SC-EXOs通过旁分泌的方式对精原干细胞的分化具有明显的促进作用(图3E-H)。
图3 支持细胞外泌体通过旁分泌途径调节精原干细胞分化为了进一步探究SC-EXOs如何影响精原干细胞的分化,作者使用了一种名为GW4869的外泌体抑制剂。GW4869可以抑制外泌体的分泌,从而阻断细胞间的通讯。在阻断SC-EXOs通讯后,发现精原干细胞的分化明显减弱。这表明SC-EXOs通过某种机制促进了精原干细胞的分化(图4F-G)。有趣的是GW4869处理SCs后GDNF的表达降低,作者考虑SC-EXOs可能是通过SCs自分泌影响自身GDNF的表达,进而对SSCs命运产生影响。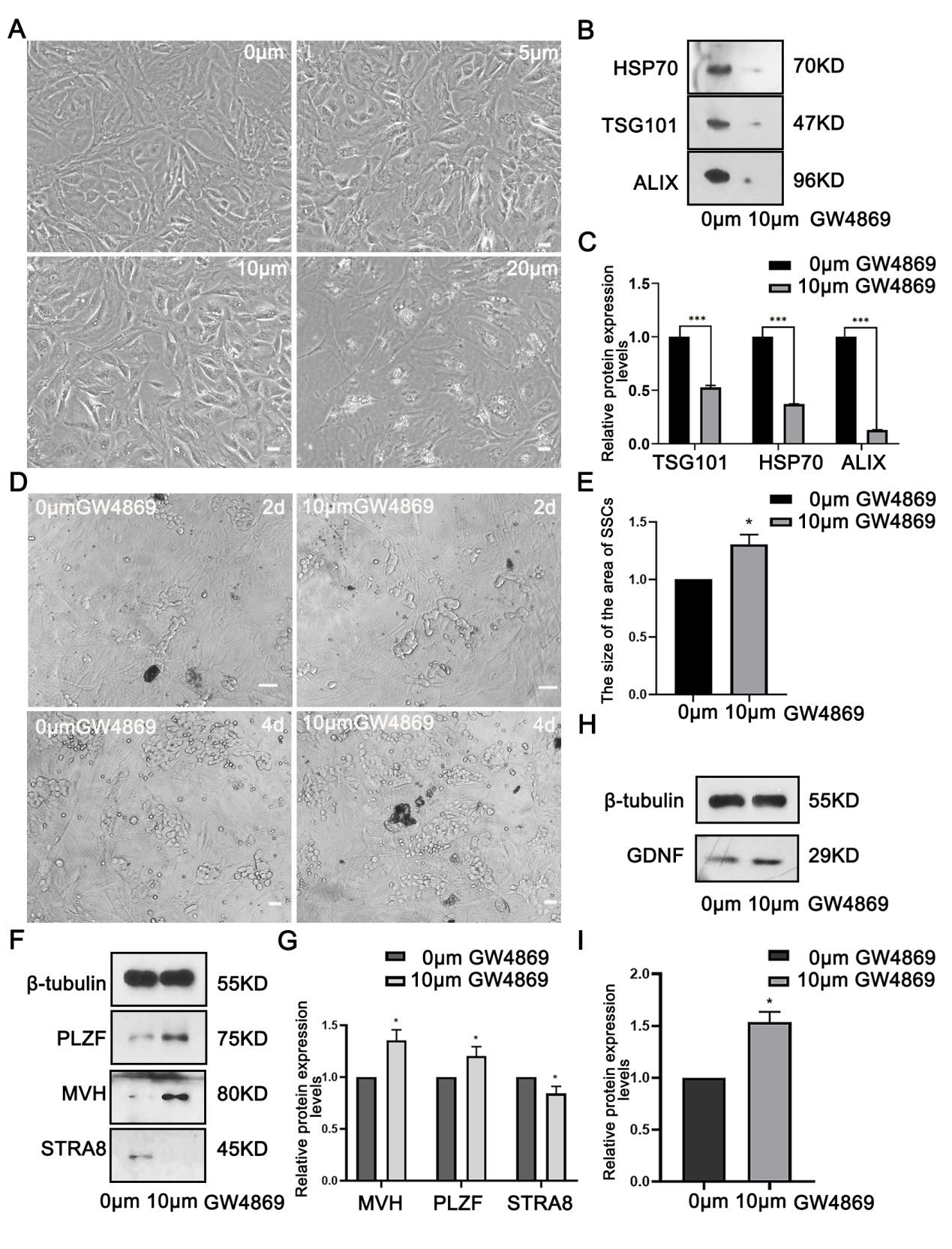
经过深入的研究,作者发现SC-EXOs中的一种microRNA——miR-493-5p,对精原干细胞的分化起到了关键的调控作用。miR-493-5p在SC-EXOs中高表达(图5A, B),抑制SCs miR-493-5p表达后与SSCs共培养发现,SSCs的ID4和GFRA1表达升高,STRA8和KIT等分化基因表达降低,另外PLZF表达量也升高可能是由于 Aal 至 A4 精原细胞数量减少导致的(图5)。同时设计了miR-493-5pmimics转染SCs与SSCs共培养结果与上述结果一致(图6)。GDNF作为一种重要的生长因子,在精原干细胞自我更新分化过程中起到了关键的作用。SC-EXOs中的miR-493-5p通过抑制GDNF,间接地促进了精原干细胞的分化,以上结果表明SC-EXOs可通过自分泌调节GDNF的表达来影响SSCs分化。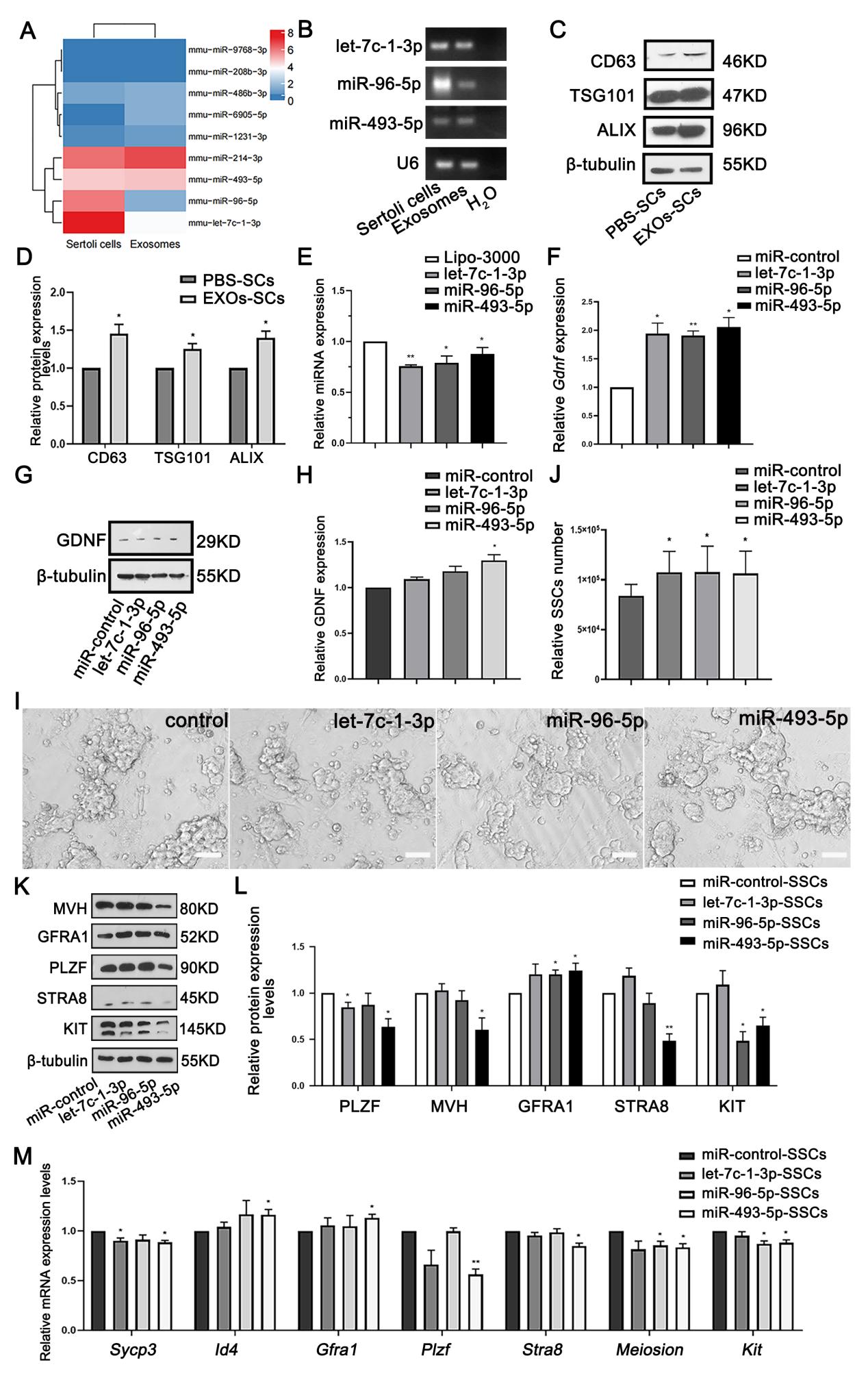
图 5 SC-EXOs通过释放改变GDNF表达的miRNA来影响SSC的自我更新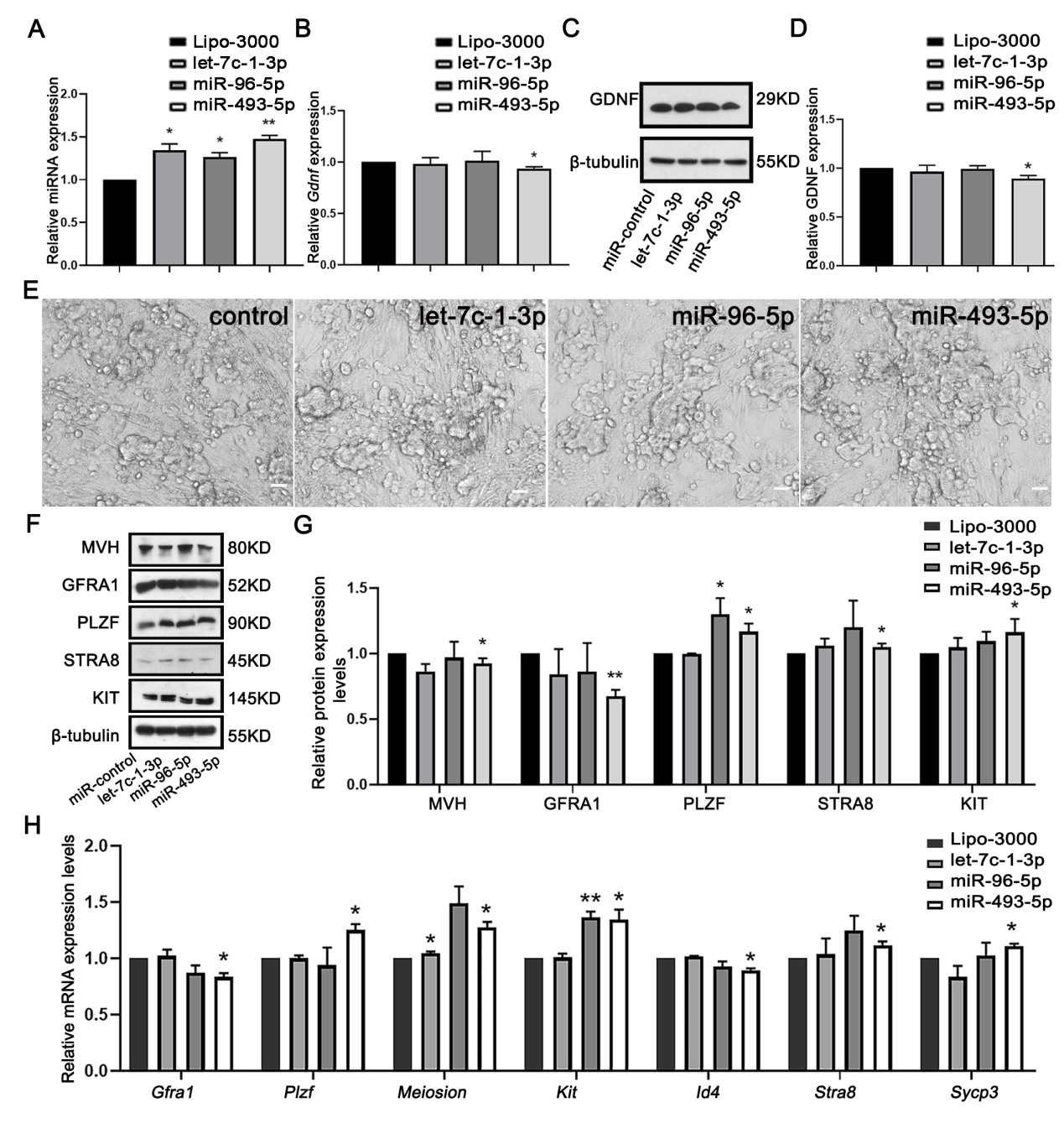
图 6 miR-493-5p对支持细胞GDNF的调节决定了精原干细胞的命运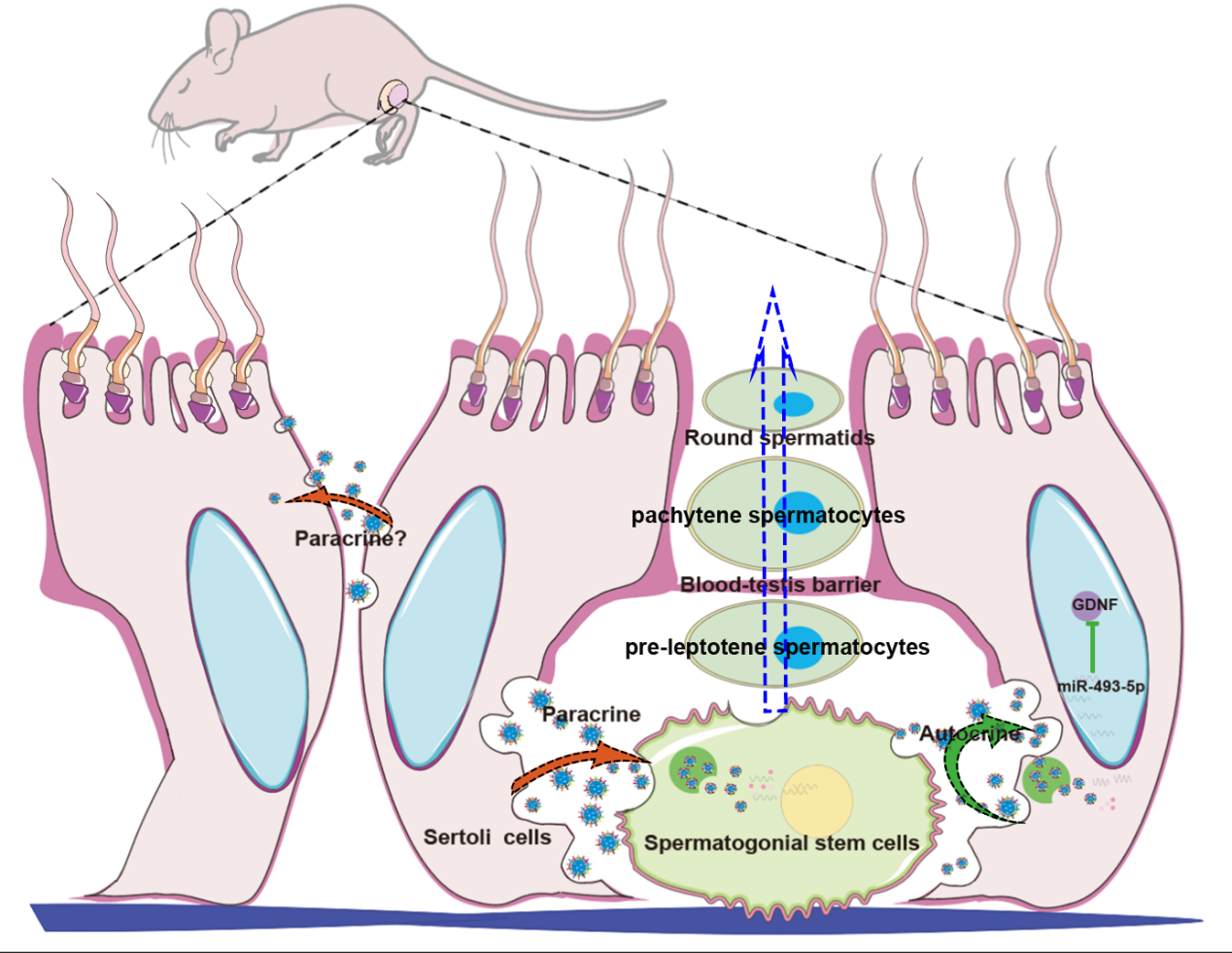
图 7 SC-EXOs 在 SSC 分化中的调控作用的机制图总的来说,研究揭示了Sertoli细胞通过分泌外泌体调控精原干细胞分化的复杂机制。这些发现不仅增加了对睾丸生殖系统发育和功能的理解,也为未来的生殖生物学和男性生殖医学研究提供了新的思路和靶点。Regulation of spermatogonial stem cell differentiation by Sertoli cells-derived exosomes through paracrine and autocrine signaling, J Cell Physiol. 2024 Jan 30. doi: 10.1002/jcp.31202.外泌体资讯网 J Cell Physiol |南京农业大学动物科技学院邹康教授团队:支持细胞起源外泌体通过旁分泌和自分泌信号调节精原干细胞分化