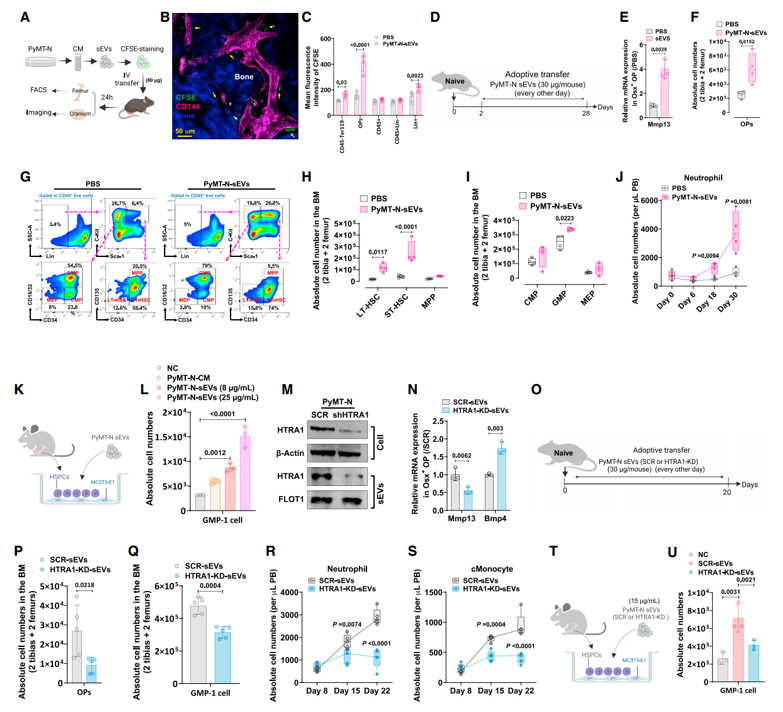
远程肿瘤如何破坏骨髓生态系统(BME),引起骨髓来源的免疫抑制细胞过度生产,其潜在机制仍不清楚。近日,贝勒医学院Xiang H.-F. Zhang教授团队在Cell Stem Cell杂志上发表文章,对乳腺癌和肺癌引起的BME转变进行了表征,包括肿瘤切除前后。远程肿瘤逐渐导致成骨祖细胞(OP)扩张、造血干细胞错位和CD41-粒系单核细胞祖细胞(GMP)聚集。肿瘤训练的BME的特征是CD41- GMP和OP之间的共定位。OP消融消除了这种效应并减少了异常粒系造血的过度生产。机制上,肿瘤来源的小细胞外囊泡携带的HTRA1上调了OP中的MMP-13,从而诱导了造血程序的改变。重要的是,这些效应在手术后持续存在并继续损害抗肿瘤免疫力。MMP-13的条件性敲除或抑制加速了免疫恢复,并恢复了免疫治疗的功效。因此,OP-GMP交流引发的肿瘤诱导系统性效应超过了肿瘤负担,需要额外治疗以扭转这些效应以获得最佳治疗效果。
骨髓生态系统(BME)是由造血干细胞和它们的生态位细胞维持的,而BME能感知许多病理性刺激,包括实体癌症。BM来源的细胞可以迁移到其他器官,并负责形成前转移灶。在许多癌症中,BM中的造血偏向粒系,导致粒系细胞的积累,这些细胞通常具有免疫抑制作用。远程肿瘤分泌的多种可溶性因子,特别是小型细胞外囊泡(如外泌体),已被证明介导了BM来源的细胞迁移、决定器官特异性转移或被参与前转移灶形成的BM细胞摄取。这种对BM的改变反过来又调节了肿瘤进展。骨髓源性抑制性细胞(MDSCs)浸润肿瘤并直接促进血管生成和转移。MDSCs的免疫抑制活动抑制了免疫反应并降低了免疫治疗效果。因此,了解肿瘤诱导的系统影响的关键机制,特别是BME造血偏向和随之而来的免疫抑制作用,至关重要。
造血干细胞和它们的生态位细胞调节了HSPCs的细胞活动和分层分化。肿瘤诱导的异常粒系造血只能通过全面表征主要HSPC和生态位细胞群体来精确定位。这促使我们将原位成像与单细胞分辨率下对远程实体肿瘤存在下的BME进行无偏倚的分析相结合。数据表明,BME在细胞组成、空间定位和基因表达方面发生了显著的改变。令人惊讶的是,发现肿瘤重编程的Osterix+细胞通过基质金属蛋白酶-13(MMP-13)的产生在破坏BME方面发挥了核心作用,从而导致肿瘤切除后持续存在的系统性免疫抑制。
远程肿瘤分泌的含有HTRA1的sEVs诱导成骨祖细胞(OP)中的MMP-13上调以破坏BME
该研究揭示了远程实体瘤对BME在转移之前的 pleiotropic 影响,包括显著的OP重编程和CD41 GMP轨迹的深刻转变。除了在调节HSPCs方面的作用外,OPs还是DTCs骨髓微环境的重要组成部分。因此,初次播种播散性肿瘤细胞(disseminated tumor cells, DTCs)将受到原发肿瘤引起的BME变化的影响,这可能是实体瘤转移行为的未知机制之一。
以前的研究已经注意到实体瘤的前转移效应。然而,BM微环境和HSPCs的详细变化以及这些变化是否可逆仍然未知。有趣的是,该数据表明,原发肿瘤引起的BME变化在肿瘤切除后不会迅速减弱。这一观察结果可能具有重要的临床意义。持续的免疫抑制及其持久的影响可能会继续保护DTCs免受辅助治疗的影响,并促进未来的转移。此外,数据表明,持久的抑制效应也可能降低依赖功能性免疫力的治疗方法的功效。尽管辅助化疗导致中性粒细胞减少,但HSPCs在化疗下可能会进一步刺激增殖和分化,这引发了髓系细胞在化疗后迅速反弹以重新建立免疫抑制的可能性。未来的工作将需要调查化疗和肿瘤引起的BME失调的联合效应。
该研究数据揭示了肿瘤诱导的系统效应的有趣异质性。NES-TNBC肿瘤对髓系造血的影响比其他肿瘤更大。该研究所呈现的数据阐明了NES肿瘤中异常中性粒细胞积累的驱动力。因此,对于具有强烈造血破坏能力的肿瘤,可能需要采取其他策略(例如针对OP来源的MMP-13)来加速BME恢复。尽管MMPs的通用抑制剂尚未成功应用于癌症治疗,但在精确定义的前转移阶段针对选择性MMPs的更具体抑制剂可能有助于克服系统性造血功能障碍并增强治疗效果。
最后,该研究发现OP细胞在支持CD41 GMPs和编排BME的全局重塑方面发挥了意想不到的作用,而肿瘤对OP的影响似乎先于其他变化。重要的是,这种作用是特定于OP而不是OB。进一步证明了肿瘤来源的sEV在介导OP重编程方面发挥了关键作用。尽管手术后sEV可能会减少,但对OP的影响是长期的,并可能受到sEV触发的表观基因组重编程的驱动。鉴定和抑制相应的表观遗传因子需要未来的研究,并可能导致新的治疗策略,以消除实体肿瘤的不良系统性影响。
参考文献:
Hao X, Shen Y, Chen N, Zhang W, Valverde E, Wu L, Chan HL, Xu Z, Yu L, Gao Y, Bado I, Michie LN, Rivas CH, Dominguez LB, Aguirre S, Pingel BC, Wu YH, Liu F, Ding Y, Edwards DG, Liu J, Alexander A, Ueno NT, Hsueh PR, Tu CY, Liu LC, Chen SH, Hung MC, Lim B, Zhang XH. Osteoprogenitor-GMP crosstalk underpins solid tumor-induced systemic immunosuppression and persists after tumor removal. Cell Stem Cell. 2023 May 4;30(5):648-664.e8. doi: 10.1016/j.stem.2023.04.005. PMID: 37146584; PMCID: PMC10165729.