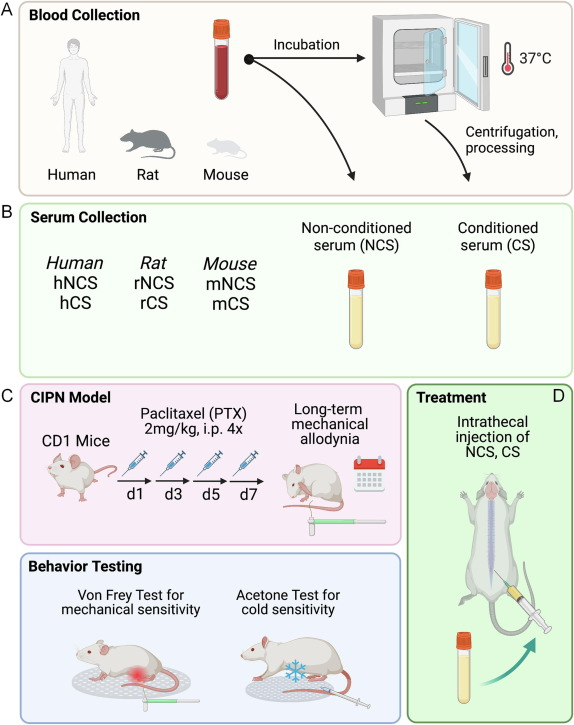
化疗诱导的周围神经病变(CIPN)是癌症化疗最常见的神经系统并发症,但缺乏有效的CIPN治疗方案。自体条件血清(ACS)富含抗炎细胞因子和生长因子,是骨关节炎患者关节内注射的一种有效的生物疗法,然而ACS在治疗周围神经病变(如CIPN)方面此前尚未进行系统的试验。来自美国杜克大学医学中心的研究人员发现,鞘内注射ACS或条件血清(CS)抑制神经胶质反应,改善CIPN后的神经传导,其机理是CS中含有高水平的抗炎介质和外泌体,CS中的外泌体很大程度上是镇痛的关键介质。相关内容以“Intrathecal Administration of Conditioned Serum from Different Species Resolves Chemotherapy-Induced Neuropathic Pain in Mice via Secretory Exosomes”为题于5月5日在线发表在国际知名学术期刊Brain, Behavior, and Immunity杂志上。周围神经病变是一种常见的不良反应,由代谢性疾病如糖尿病和暴露于毒素如化疗药物而引起。化疗引起的周围神经病变(Chemotherapy-induced peripheral neuropathy,CIPN)尤其成为了重大问题,超过50%的紫杉醇治疗患者受到CIPN影响,这会限制了癌症治疗的治疗剂量。化疗导致表皮神经支配丧失、炎症细胞浸润、神经炎症和神经性疼痛。CIPN还导致脊髓胶质细胞(如星形胶质细胞和小胶质细胞)和背根神经节(DRG)内卫星胶质细胞的强烈激活,导致促炎细胞因子和趋化因子的上调,从而促进神经性疼痛。一些常用的治疗神经性疼痛的药物用于缓解CIPN,如加巴喷丁类药物、三环抗抑郁药和5-羟色胺-去甲肾上腺素再摄取抑制剂。不幸的是,这些药物选择通常会产生副作用,并且在治疗CIPN时效果有限,需要寻找新的镇痛剂治疗慢性周围神经性疼痛。基于生物的再生疗法,如富血小板血浆(PRP)、自体条件血清(ACS)和间充质干细胞(MSCs),越来越多地用于骨关节炎和肌肉骨骼疾病的治疗。PRP是一种较常用的生物疗法,可以相对容易地从血液样本中产生。然而,由于不同的处理技术和不一致的结果,这种治疗仍然存在争议。骨髓间充质干细胞治疗也很常见,虽然MSC疗法的作用机制最初被认为是次于软骨和其他受损组织的细胞替代,但最近的研究认为,MSC疗法的镇痛主要是由生长因子、抗炎细胞因子和神经免疫调节驱动的。研究团队此前已经证明,MSC的鞘内给药通过TGF-β1介导的神经免疫调节而产生长期镇痛效果。然而,这些间充质干细胞技术需要多个步骤,包括组织收获、细胞培养以及全身或鞘内细胞注射的潜在安全性问题。基于这些原因,研究人员希望采用一种血液来源的、无细胞的生物疗法,即ACS,探索其是否能成为一种易于部署的、有效的治疗神经损伤疼痛的方法。ACS目前在美国和欧洲的临床应用中,已被证明对治疗骨关节炎和退行性肌肉骨骼疾病有效。ACS也被成功用于治疗神经性脊柱疾病(腰椎和颈椎神经根病)和三叉神经痛。这种生物疗法的镇痛作用被认为是继发于IL-1Ra、TGF-β、HGF、IL-10和其他合成代谢细胞因子浓度的增加。特别是,IL-1Ra在ACS的产生中急剧增加,被认为是主要的镇痛细胞因子之一。虽然在治疗神经根和三叉神经方面有效,但使用ACS治疗多神经病变(如CIPN)的试验仍然缺乏。为了研究ACS在这种神经性疼痛状况下产生益处的机制,研究人员进行了一系列实验来评估ACS的跨物种行为效应(人-小鼠、大鼠-小鼠、小鼠-小鼠,见示意图)、治疗后神经功能的变化,以及ACS所含神经免疫因子和外泌体等囊泡的镇痛作用。由于本研究进行了跨物种比较,因此使用了“条件血清(CS)”一词更为规范,而不是“自体条件血清(ACS)”。研究人员发现,单次鞘内注射人来源的条件血清(hCS)对紫杉醇化疗引起的小鼠神经性疼痛(机械性异常痛)产生持久的抑制作用,而不会引起运动障碍。与非条件人血清(hNCS)相比,hCS的镇痛作用在治疗后8周仍保持不变。此外,大鼠或小鼠将hCS转移到雌雄小鼠身上,完全再现了小鼠hCS转移引起的疼痛缓解,表明了跨物种和跨性别的有效性。在机制上,CS治疗阻断了化疗诱导的脊髓胶质反应,改善了神经传导。与NCS相比,CS含有更高浓度的抗炎和促溶解介质,包括IL-1Ra、TIMP-1、TGF-β1和溶解蛋白D1/D2。鞘内注射抗TGF-β1和抗IL-1Ra抗体可短暂逆转CS的镇痛作用。纳米颗粒跟踪分析显示,大鼠CS中外泌体的数量明显高于NCS。重要的是,通过高速离心去除外泌体在很大程度上减少了ACS产生的疼痛缓解,这表明囊泡(外泌体)在ACS的有益作用中起着关键作用。这些研究结果表明,鞘内CS通过小囊泡/外泌体和神经免疫/神经胶质调节的组合显著缓解了神经性疼痛。参考文献:Intrathecal Administration of Conditioned Serum from Different Species Resolves Chemotherapy-Induced Neuropathic Pain in Mice via Secretory Exosomes. Brain Behav Immun. 2023 May 5:S0889-1591(23)00111-3.外泌体资讯网 Brain Behav Immun丨鞘内注射条件血清通过外泌体途径改善化疗引起的神经性疼痛