牛津大学研究人员最新的报道揭示了一种潜在的新途径,可以阻止细胞回收系统中制造的一组特定外泌体,这些外泌体可以促进癌性肿瘤的生长。
外泌体是在所有身体细胞内部形成的纳米级细胞外囊泡,位于膜包裹的区域内,并在这些区域与质膜融合时释放。它们的多分子载荷,包含蛋白质、RNA和其他分子混合物,使它们能够发送复杂信息以重新编程目标细胞。虽然外泌体在健康生理过程中发挥重要作用,如免疫和生殖,但它们也推动疾病过程,如癌症进展和转移。
Deborah Goberdhan副教授的团队与肿瘤学系Adrian Harris教授合作,作为他们关于人类外泌体功能持续工作的一部分,在果蝇外泌体生物学的细胞模型上进行了互补实验。此前,研究人员协作团队已经确定了一组特定的外泌体Rab11a-外泌体,在称为回收内质网的区域中制造。这些Rab11a-外泌体携带不同的载荷集合,有助于癌症生长并对常用治疗方法产生抵抗力。
在新近发表的研究中,该团队现已确定了一种选择性阻止Rab11a-外泌体产生的方法。研究还表明,尽管这些囊泡只占肿瘤细胞释放出来的所有囊泡中很小一部分,但它们在果蝇生殖和与人类癌症进展相关联的信号传导中起着至关重要的作用。
Goberdhan副教授说:“外泌体的大多数功能研究都必须依赖分泌囊泡的复杂混合物,无法区分具有关键生物活性的外泌体的来源。我们的工作克服了这些问题,并提供了一种强大的新工具,可用于开发癌症等外泌体相关疾病的生物标志物以及新疗法。”
CliveWilson教授补充说:“研究果蝇和人类细胞为我们解决这个问题提供了独特的优势。我们已经能够使用果蝇快速测试人类细胞工作产生的想法,然后利用这些发现来确定癌细胞中Rab11a-外泌体的特异性机制。”
该合作团队目前正在研究控制Rab11a-外泌体形成的其他药物机制以及该信号与其他疾病的相关性。
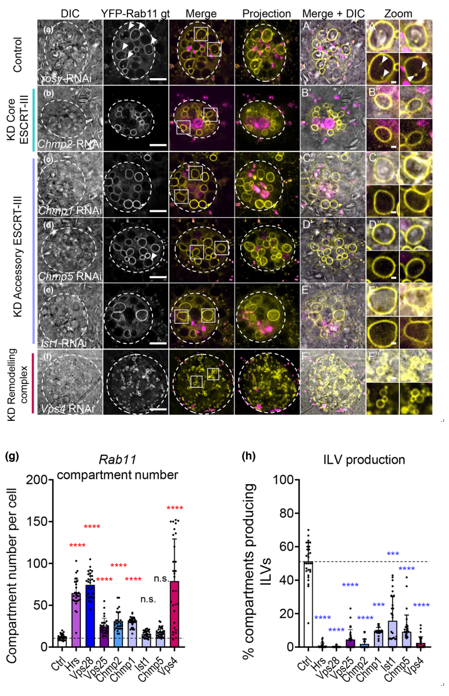
ESCRT-III敲低抑制非酸性SC区室中的外泌体生物发生,但不改变区室特性。
外泌体是分泌型纳米囊泡,具有强大的信号活性,最初在Rab7阳性多泡内体中以管腔内囊泡(ILV)的形式形成,并且在循环Rab11a阳性内体中形成,特别是在某些形式的营养胁迫下。运输所需的内体分选复合体(ESCRT)的核心蛋白参与外泌体生物发生和ILV介导的泛素化货物破坏。辅助ESCRT-III组件已报告在ESCRT-III介导的囊泡分裂中的作用,但它们的确切功能定义不明确。它们通常只在压力下显得必不可少。人类小细胞外囊泡的比较蛋白质组学分析表明,在富含Rab11a的外泌体制剂中,附属的ESCRT-III蛋白CHMP1A、CHMP1B、CHMP5和IST1增加。研究表明,这些蛋白质是在果蝇二次细胞循环核内体中形成ILV所必需的,但与核心ESCRT不同的是,它们不参与晚期核内体中泛素化蛋白质的降解。此外,人类HCT116结直肠癌细胞中的CHMP5敲低选择性地抑制Rab11a-外泌体的产生。辅助ESCRT-III敲低抑制了次级细胞的精液介导的生殖信号传导和来自HCT116细胞的含有Rab11a外泌体的EV的生长促进活性。作者得出结论,附属的ESCRT-III成分在Rab11a-外泌体的生成中具有特定的、泛素依赖性的作用,这种机制可能有针对性地选择性地阻断这些囊泡在癌症中的促肿瘤发生活性。
参考文献:
Marie PP, Fan SJ, Mason J, Wells A, Mendes CC, Wainwright SM, Scott S, Fischer R, Harris AL, Wilson C, Goberdhan DCI. (2023) Accessory ESCRT-III proteins are conserved and selective regulators of Rab11a-exosome formation. J Extracell Vesicles 12(3):e12311.
外泌体资讯网 JEV:牛津大学鉴定出癌症进展中的关键外泌体亚型





