系统性将信使RNA(mRNA)递送至肝、脾和肺以外的器官仍然具有挑战性。为了克服这个问题,Science Advances杂志近日发表的一篇文章假设改变纳米颗粒的化学和给药途径可能使mRNA诱导的蛋白质在网状内皮系统之外表达。该报道描述了一种使用脂质纳米颗粒有效且特异性地将mRNA递送至胰腺的策略。通过腹膜内给药递送含有阳离子辅助脂质的脂质纳米颗粒会在胰腺中产生稳健且特异性的蛋白质表达。大多数产生的蛋白质表达发生在产生胰岛素的β细胞内。胰腺mRNA的递送依赖于腹膜巨噬细胞外泌体分泌的水平基因转移,这是一种影响mRNA脂质纳米颗粒递送的未被充分认识的机制。作者预计这一策略将使基因疗法能够治疗难治性胰腺疾病,如糖尿病和癌症。
mRNA疗法在疫苗接种、蛋白质替代、基因编辑、免疫疗法和组织再生方面具有几乎无限的临床潜力。这种临床效用,特别是对于mRNA疫苗,可以通过它们对正在进行的SARS-CoV-2大流行的抑制来证明。鉴于这一成功,作者预计用于其他应用的mRNA疗法的临床转化将激增。然而,要充分释放mRNA药物的潜力,该领域必须首先开发能够进入病变细胞和组织的递送系统。
需要递送系统,因为“裸”mRNA具有不利的药代动力学特性,并且在到达靶细胞的细胞质之前会迅速降解和清除,在那里翻译成功能性蛋白质。有效的递送系统必须保护mRNA免受体内核酸酶降解,诱导靶细胞摄取,并将mRNA从内体释放到细胞质中。尽管脂质纳米颗粒(LNP)是经过验证的RNA递送系统,但它们中的大多数将mRNA递送至免疫细胞和肝细胞外的细胞靶标的能力有限。疫苗通过肌肉注射有效地将mRNA传递给免疫细胞,而蛋白质替代和免疫疗法通常需要静脉内给药。例如,美国食品和药物管理局批准的小干扰RNA(siRNA)LNP药物patisiran可在静脉注射至肝细胞后治疗遗传性转甲状腺素蛋白淀粉样变性。此外,最近由Intellia Therapeutics和Regeneron进行的一项临床试验产生了使用RNA-LNP介导的基因编辑治疗淀粉样变性的积极数据。这些成功凸显了RNA-LNP治疗疾病的潜力。然而,在实现将RNA全身递送至肝脏和脾脏以外的器官方面进展甚微。
可以调整mRNA-LNP设计和递送的几个方面以追求转染困难的细胞靶标,包括脂质成分、mRNA序列、给药途径和主动靶向的结合媒介。LNP通常包含四种脂质成分:可电离脂质、两亲性磷脂(即辅助脂质)、胆固醇和聚乙二醇(PEG)脂质。可电离脂质一直是LNP开发的主要焦点,因为它在内体内局部pH值下降时通过质子化促进内体逃逸方面发挥着关键作用。然而,大型库的筛选发现很少有材料可以将mRNA传递到肝脏和脾脏之外。替代给药途径可以避免这个问题,正如作者的实验室和其他人所证明的那样,将mRNA递送至器官,包括心脏、大脑和肺。肝外mRNA递送也可以通过掺入带电荷的两亲性磷脂来实现,这会将蛋白质表达从肝脏转移到脾脏或肺部。
尽管取得了这些进展,但将mRNA-LNP递送至胰腺细胞仍然具有挑战性。这种疗法可以为无法治愈的胰腺疾病(例如癌症和糖尿病)提供挽救生命的治疗方法。胰腺执行内分泌和外分泌功能;朗格汉斯岛中的细胞负责维持葡萄糖稳态,而腺泡细胞将消化酶分泌到十二指肠。已经使用病毒递送系统证明了胰腺mRNA递送的临床潜力。例如,Gittes及其同事表明,将病毒基因递送至胰腺可再生产生胰岛素的β细胞,作为自身免疫性糖尿病的一种疗法。虽然病毒载体是有效的细胞换能器,但它们存在整合到宿主基因组中的风险并且具有高度免疫原性,这限制了它们重复给药的能力。此外,它们在胰腺中的治疗用途需要使用内窥镜逆行胰胆管造影术通过胰管注射,这是侵入性的并且有诱发胰腺炎的风险。
作为病毒基因治疗的替代方案,作者希望开发mRNA-LNPs以使非病毒基因能够传递到胰腺。此外,还想减少所需输液程序的侵入性。为实现这一目标,转向腹膜内注射,这是一种有效的策略,可以将药物选择性地输送到腹膜腔内的疾病部位,例如卵巢和胰腺肿瘤。与静脉内给药相比,腹膜内给药可降低全身毒性,提供更高的生物利用度,并延长与腹膜器官靶标的接触,因为纳米粒子在腹膜腔内的高度滞留。
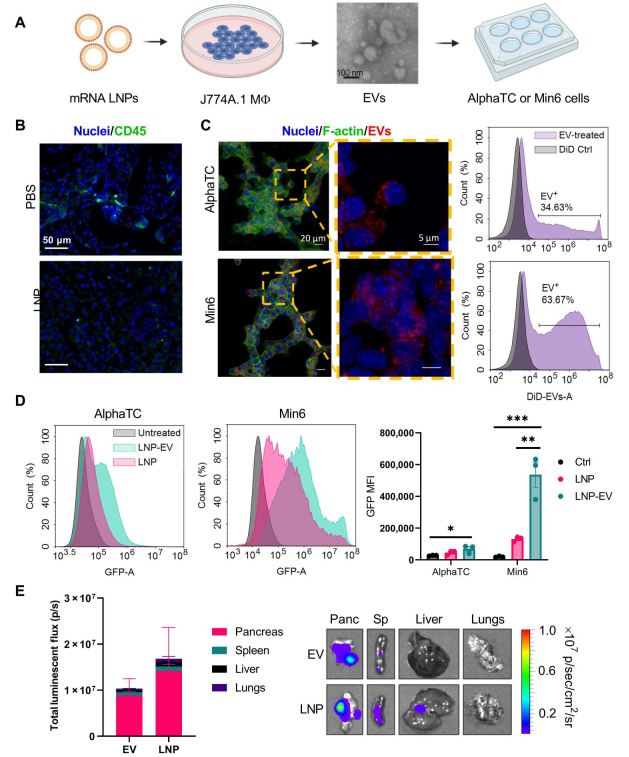
该研究描述了一种LNP制剂,它可以有效和选择性地将mRNA递送到胰腺。研究表明,mRNA-LNPs的腹膜内递送在胰腺中诱导了结构不同的可电离脂质的强蛋白表达。该策略主要在β细胞中诱导蛋白质表达,β细胞是位于胰岛中的胰岛素生成细胞。此外,腹膜巨噬细胞细胞外囊泡(EV)转移促进了mRNA的递送,并且功效与全身毒性无关。总之,这些数据表明mRNA-LNP是一种可行的非病毒方法,可在难以转染的胰腺细胞中诱导蛋白质表达。
从LNP处理的巨噬细胞中分离出的EV转染胰岛细胞
参考文献:
Melamed JR, Yerneni SS, Arral ML, LoPresti ST, Chaudhary N, Sehrawat A, Muramatsu H, Alameh MG, Pardi N, Weissman D, Gittes GK, Whitehead KA. Ionizable lipid nanoparticles deliver mRNA to pancreatic β cells via macrophage-mediated gene transfer. Sci Adv. 2023 Jan 27;9(4):eade1444. doi: 10.1126/sciadv.ade1444. Epub 2023 Jan 27. PMID: 36706177.