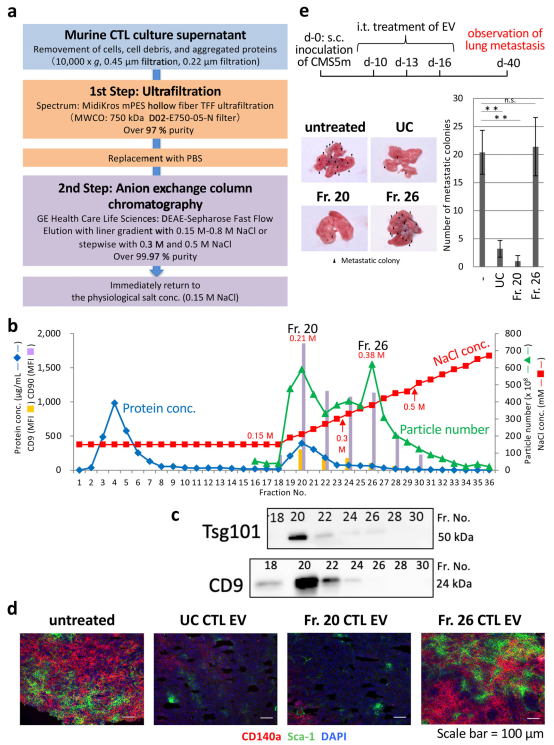
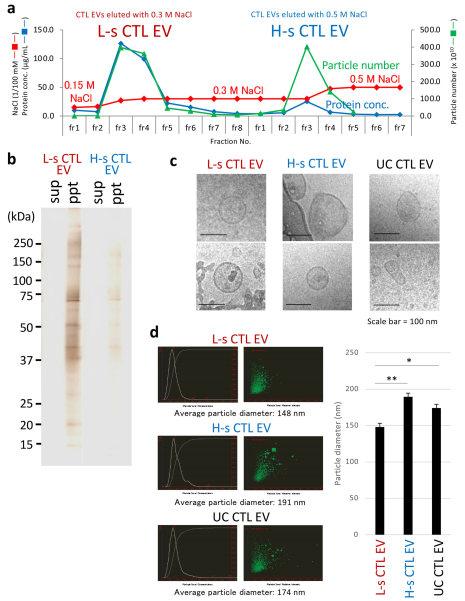
究细胞外囊泡(EV)的可靠生物活性和药物发现需要开发一种新的大规模纯化方案。为了解决这个问题,近日JEV杂志上的一篇文章提出了一种通过使用阴离子交换法制备高性能外泌体(EXO)的有效方法。来自4L培养上清液的细胞毒性T淋巴细胞(CTL)EV通过220nm截止过滤器分为两个群体,去蛋白率超过99.97%,分别在低(0.15M–0.3M)和高NaCl浓度(0.3M–0.5M)条件下洗脱(分别约为2×1012和1.5×1012颗粒)通过阴离子交换柱色谱。前者富含EXO蛋白,包括晚期内体相关蛋白和rab家族和整合素家族蛋白,以及功能性微(mi)RNA,并具有通过消耗原发性肿瘤病变中的间充质细胞群来预防肿瘤转移的生物活性。相比之下,后者是微泡(MV)样颗粒,包括DNA、核心组蛋白和核糖体蛋白,以及功能未知的富含GC的miRNA,容易被甘露糖受体+枯否细胞吞噬。因此,阴离子交换法适用于大规模分离具有生物活性的EXO和类似MV的EV,后者携带高纯度危险核酸货物。
包括免疫细胞在内的多种细胞会释放脂质双层膜细胞外囊泡(EV),例如晚期内体衍生的外泌体(EXO,也称为小EV)和质膜出芽形成微泡(MV,也称为大EV,包括凋亡小体、oncosomes和ectosomes),直径分别为50-200和100-2000nm(直径约为100-200nm的EV是EXO和MV的混合物)。最近报道了直径小于50nm的非膜外泌颗粒(exomeres)。EXO来源于内溶酶体系统,并通过由外泌体标记蛋白(例如凋亡相关基因2相互作用蛋白X(Alix)和肿瘤易感基因(Tsg)101)介导的转运所需的内体分选复合物 (ESCRT)介导多泡体[MVB]作为腔内囊泡(ILV)生成,并通过MVB与质膜融合而释放。然而,通过已知的ESCRT依赖性和非依赖性EXO形成途径以及来自肿瘤细胞系的EV中微(mi)RNA和蛋白质的不同包装机制,从单个细胞系释放的EV是结构异质的群体。在临床使用的EV药物发现中,关键是根据其功能确定颗粒类型并尽可能对其进行分离和纯化。
与质膜来源的MV不同,据预测,EXO膜富含由以鞘磷脂和神经节苷脂为代表的鞘脂,已知它们通过阻断神经酰胺生物合成和积累四跨膜蛋白分子(如CD9、CD63和CD81)来防止晚期内体中的ILV出芽;另外还富含糖基-磷脂酰肌醇锚定蛋白,例如CD90、G蛋白偶联受体和胆固醇。据报道,在一项使用具有高分辨率密度梯度的分级EV的研究中,EXO不含DNA。此外,一份报告指出,在前列腺癌患者的血浆中,大型EV而非小型EV含有DNA。所有类型的EV都被广泛认为表现出负电荷,因为位于活细胞质膜内叶的阴离子磷脂酰丝氨酸(PS)暴露在EV膜的外叶上,如同死细胞那样。有趣的是,一些研究报告称,与其他EV相比,EXO对PS结合蛋白AnnexinV和lactadherin的亲和力较弱,这表明EXO可以根据细胞膜负电荷的差异与源自质膜的EV分离。
基于超速离心(UC)的分离技术被广泛用作表征EV生物学意义的金标准方法。除了无法区分MV、EXO和exomeres外,在应用UC方法时,培养上清液中的不溶性聚集蛋白也会与EV一起沉淀。在定量实验固有的困难下,EV之间的聚集以及培养基衍生蛋白质与EV的非特异性结合显著损害了UCEV生物活性的可靠性。使用碘克沙醇的密度梯度离心和使用对CD9、CD63和CD81四跨膜蛋白分子特异的mAb以及对PS特异的T细胞免疫球蛋白和含有粘蛋白结构域的分子4(TIM-4)的亲和分离经常用于EV制备。尽管基于密度梯度和亲和力的方法可以获得高纯度的EV,但很难制备大量EV用于物理化学分析和研究EV的详细生物学特性。此外,在PS靶向制备方法中,可能会遗漏具有低负膜电荷的EV。
DEAE柱色谱法在低盐浓度下洗脱生物活性CTL EV
作者此前在鼠类研究中阐明,CD8+CTL EV通过其内容物(例如miR-298-5p)调节原发性肿瘤病变中的间充质细胞群来预防肿瘤转移。这项研究描述了一种基于这种生物学特性的高纯度大规模EV制备方法,使用阴离子交换法,并阐明了详细的生理特征,包括蛋白质、膜脂和miRNA分布以及DNA含量,表面糖基化和靶细胞特异性。得出结论,阴离子交换法最适合临床应用中符合良好生产规范(GMP)的EV制备。
纯化的L-s和H-s CTL EV的形态和粒径差异
参考文献:
SeoN, Nakamura J, Kaneda T, Tateno H, Shimoda A, Ichiki T, Furukawa K, HirabayashiJ, Akiyoshi K, Shiku H. Distinguishing functional exosomes and otherextracellular vesicles as a nucleic acid cargo by the anion-exchange method. JExtracell Vesicles. 2022 Mar;11(3):e12205. doi: 10.1002/jev2.12205.PMID: 35289089.