作者:养太大的斑点狗
关于细胞外囊泡(Extracellular vesicles, EVs)作为一个载体来实现细胞-细胞间物质交换的报道已经有许许多多。目前这一领域更加的流行的趋势是研究EVs所负载的核酸信息,比较典型的如miRNA还有LncRNA对于癌旁组织的影响,以及在转移前对多个脏器微环境的重塑等等方面。作为分子层面调控的另一类重要效应分子,关于EVs负载或者表达的蛋白质对于下游信号的报道则相对较少。这其中,分析EVs携带的蛋白信息与母体细胞所表达的同种蛋白在生物学功能上的差异的研究目前仍处于缺失状态。正是基于此,本文研究了典型的两种EVs,外泌体和微囊泡(microvesicles)所携带的生长因子受体蛋白与母体细胞所表达的蛋白表达量以及与下游靶标结合力的差异性。 其研究结果表明了我们目前更为关注的外泌体携带蛋白的细胞功能与母体差异相较于微囊泡而言更大,换言之,微囊泡对于那些对母体细胞蛋白功能更感兴趣的研究者而言是个更理想的研究对象。
研究方法:
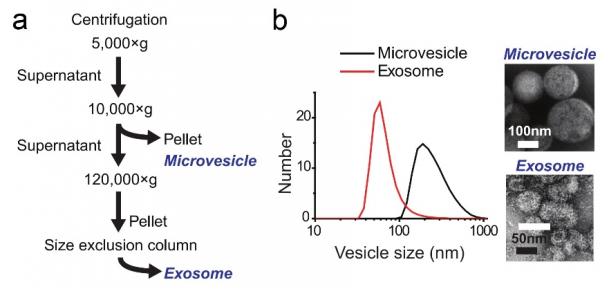
研究者首先通过梯度离心的方式收集了微囊泡以及外泌体,所用的实验参数如下图中(a)所示,作者对于这两类EVs的尺寸进行了两个层面的表征,一个是在溶液中的水合粒径分析(b),另一个是负染后的透射电镜分析,比较遗憾的是作者在此处处理图片时留下了一个漏洞,关于外泌体的电镜照片中出现了两个标尺,结合动态光散射的结果,以及颗粒水合半径通常略大于其真实物理半径的特点,我们推断其中较长的白色标尺可能是正确的
图:(a)两种类型的EVs富集过程以及(b)关于尺寸信息的表征。
第二步,也是本文的关键,研究者们选定了内皮细胞生长因子受体(epidermal growth factor receptor, EGFR)作为目标分子。选定这个蛋白是综合考虑了多个前提,首先最重要一点是这个蛋白要在外泌体和微囊泡上都有表达,作为一个膜蛋白,EGFR既能被直接通过膜出芽方式形成的微囊泡所携带,也可以在其与生长因子结合后经由内吞进入内涵体,并且最终通过多囊小体(multivesicular body)途径被外泌体所携带;其次,这一蛋白应当具有广泛的生物学意义以及诸多下游蛋白,这样才能为进一步的实验找到多个合适的下游靶标,这一点EGFR作为与细胞增殖相关的上游信号,完美符合;再者,EGFR作为常见的肿瘤突变蛋白之一,关于它的分子生物学研究也具有一定的临床价值。
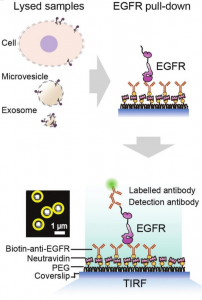
选定研究靶点后,接下来作者首先分析了EGFR蛋白在这两类EVs上的表达量差异,对于EVs的总蛋白定量较为容易,通过常规BCA实验即可以实现,而对于EGFR数目的定量,作者选用了基于全内反射的单分子pull-down 分析,其原理如下图所示
图:基于全内反射的pull-down分析EVs表面EGFR蛋白表达量。
这里,pull-down的原理与免疫共沉淀类似,只是前者是将能与目的蛋白结合的抗体固定于膜或者色谱柱表面,在本文中,是将抗体预先包被于玻璃片上,而后通过类似于钓鱼的方式,最终每个抗体可以与单一的EGFR分子结合,而后再通过一抗-二抗进行间接免疫荧光标记。在全内反射显微镜下,可以观察如上图中所示的马赛克状团簇,每一个团簇代表一个阳性计数的分子,基于这种方式,作者观察到微囊泡的EGFR相对表达量于母体细胞更为接近,Pearson系数(用于表征两个参量的关联性,数值越大关联程度越高)高于外泌体20%以上,换用了EGFR表达量不同的多个细胞系也能得到类似结果。
而后作者分析了在不同条件下这些囊泡中所携带的EGFR蛋白与下游蛋白的作用力。为了实现这个目的,作者做了如下的准备,首先是在上一个实验的基础上选取了更多的细胞系,新纳入的细胞系中有的存在EGFR的新位点突变,导致这些蛋白在母体状态下对所选取的三个下游靶标亲和力有显著差异,这样在后续实验中,不仅针对同种下游蛋白的结合力在三者间可以进行比较,对于不同蛋白的选择性能否得到保留也成为一个重要的研究目标。而后,作者通过eGFP与所选取的三个EGFR的靶标蛋白分别进行融合,基于同一细胞系构建三株单一蛋白荧光标记的亚型。这些细胞打碎后的残片与固定在预先包被的玻璃片上来自于不同种EVs的EGFR蛋白相互作用,最终通过类似于EGFR计数的方式,半定量分析了EGFR与不同靶标的结合力,这里我们认为基于表面等离子体共振(Surface plasmon resonance, SPR)方式测量的结合力常数可能更加适合用来分析PPI的结合强度。
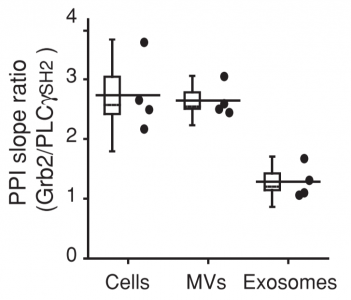
通过综合多个细胞来源的EVs与下游蛋白结合强度分析,研究者发现微囊泡相较于外泌体而言,其与下游蛋白的结合力与母体细胞一致性更高。另一个更重要的结果如下图所示,微囊泡来源的EGFR对于两个不同靶标的结合力差异与母体细胞高度一致,而外泌体来源的EGFR则表现出了较低的选择性。
图:母体,微囊泡,外泌体来源蛋白对于下游靶标的结合强度差异。Cells:母体细胞;MVs:微囊泡;Exosome:外泌体。
针对这一选择性差异,作者从两类EVs的来源上进行了推测。正如我们前面所描述的,微囊泡的形成主要依赖细胞膜出芽的方式,此时EGFR功能未受到任何影响。而作为一种膜蛋白,EGFR能够出现在细胞内来源的外泌体中的条件就是它们需要被内吞入细胞,这一过程通常伴随着EGFR与受体的结合,构象的改变,以及最为重要的,酪氨酸残基的磷酸化,从这个角度看,虽然EGFR可以被外泌体所募集,但是其结构已经发生了一定程度的改变,最终的体现就是研究者所观察到的与下游蛋白的结合能力以及选择性的变化。
本篇报道为后续针对外泌体的研究开启了一个崭新的方向,作为一项初步研究,本文更加强调了单分子分析计数对于EVs研究的重要性,并且寻找到了母体与分泌囊泡在蛋白质功能层面相关性这一前人没有关注的领域,后续的方向,我们认为可以在蛋白质与RNA,RNA与RNA等结合上进行进一步的分析,此外这里还有一个有趣的问题,既然外泌体富集的蛋白可能在功能上与母体细胞蛋白不同,那么是否能用来解释一些外泌体对于旁观者细胞甚至基质的改造作用,是否存在这样一类生物学功能,其变化的关键就是这些外泌体所募集的异变蛋白?
参考文献:
Mi Sook Sung, Jik-Han Jung, Cherlhyun Jeong, Tae-Young Yoon, Ji-Ho Park. Single-Molecule Co-Immunoprecipitation Reveals Functional Inheritance of EGFRs in Extracellular Vesicles Small 2018, 1802358.