氨基酰-tRNA合成酶(Aminoacyl-tRNA synthetase,ARS)是蛋白质合成的一个必需酶,可以将氨基酸与其同源tRNA连接在一起,为蛋白质的生物合成提供原料。然而,ARS也会与其他各种信号通路间产生联系,参与调控信号通路。在一些ARS相关研究中发现,ARS可以被分泌到细胞外环境里 (Son et al.,2014)。根据先前的研究报道,分泌到胞外环境的ARS在血管生成(Mirando et al.,2014)、免疫应答 (Park et al.,2005b)、组织再生(Park et al., 2005c)、肿瘤发生(Choi et al., 2011)等调控中发挥作用。然而,该分泌途径仍然是未知的。其中,作为可分泌的ARS的类型之一,赖氨酰-tRNA合成酶(KRS)在此前的研究中被认为可从癌细胞中分泌并诱导炎症反应。为了深入了解ARS的分泌机制,来自韩国首尔国立大学的研究人员在JCB(最新IF=7.955)上发表论文,研究了KRS的分泌过程,并进一步探索其如何从癌细胞中分泌的细节。
人胞内赖氨酰-tRNA合成酶(KRS)由597个氨基酸组成,其中包括了反密码子结合区域(S70-P214)和催化结构域(L220-K574)。它还包含一个独特的N-末端延长段。在经过特异性的磷酸化后,KRS结构发生变化,从而发挥不同的作用。例如,在位于两个功能结构域的连接处的207位丝氨酸(S207),其在活化的肥大细胞中会被磷酸化,其磷酸化会将两个功能结构域分离,从而使酶失活。然后S207磷酸化的KRS转移到细胞核中通过转录因子MITF进行转录调控。另外,KRS位于N末端延伸区的52位苏氨酸(T52)会被层粘连蛋白信号磷酸化。该磷酸化诱导N-末端延伸区的解折叠,然后将其引导其与质膜结合。膜结合的KRS与67kD的层粘连蛋白受体相互作用并促进细胞迁移和癌症转移。
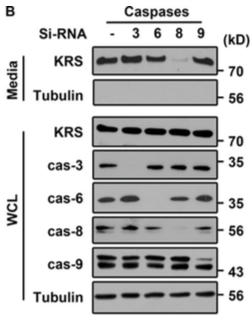
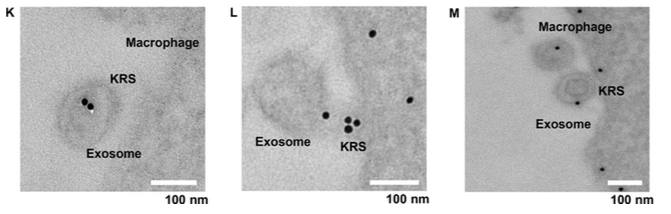
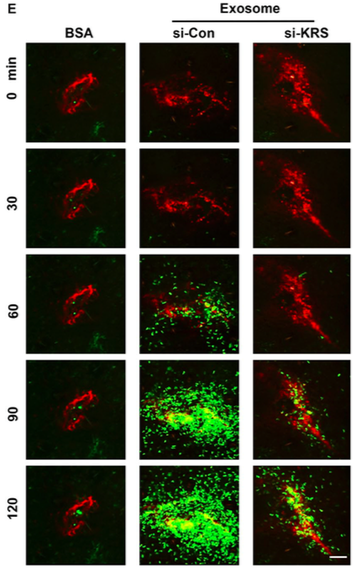
氨基酰-tRNA合成酶(ARS)可以分泌并在细胞外环境中并具有不同的活性,但是其分泌机制尚不清楚。在本研究中,研究人员描述了ARS之一——赖氨酰-tRNA合成酶(KRS)的分泌途径以及这种途径如何受Caspase活性调节,这是一种蛋白质的非常规分泌方式。研究人员发现,KRS是可以通过结肠直肠癌细胞分泌的外泌体进行分泌的,并可引起炎症反应。Caspase-8切割KRS的N末端,从而暴露位于KRS C末端的PDZ结合基序。合成素与KRS暴露的PDZ结合基序结合,促进KRS从多tRNA合成酶复合物中分离,并通过外泌体分泌到细胞外。由癌细胞释放的含有KRS的外泌体诱导巨噬细胞迁移,其分泌的TNF-α和切割的KRS对巨噬细胞迁移活性起到重要作用,这是Caspase-8可以促进炎症的一个新机制。综上,本研究揭示了KRS是如何分泌到细胞外环境中并是如何发生翻译后修饰的研究成果。
图1:Caspase-8调控KRS
图2:癌细胞外泌体中的KRS进入巨噬细胞
图3:含有KRS的外泌体促进巨噬细胞的集聚及炎症反应(绿色信号是巨噬细胞)
参考文献:Kim SB et al. Caspase-8 controls the secretion of inflammatory lysyl-tRNA synthetase in exosomes from cancer cells. J Cell Biol. 2017 Jun 13. PubMed PMID: 28611052.
原文下载:http://www.exosome.com.cn/thread-1615-1-1.html?_dsign=3a6874ba
版权所有,未经许可禁止转载。转载请联系本网站获取授权。