近日,空军军医大学口腔医院组织工程中心金岩教授课题组和中山大学光华口腔医学院华南颅颌干细胞转化研究中心施松涛教授课题组合作,在Journal of Extracellular Vesicles杂志(IF=14.976)发表了题为“Apoptotic vesicles restore liver macrophage homeostasis to counteract type 2 diabetes”的论文,阐明了间充质干细胞(mesenchymalstem cells, MSCs)来源凋亡囊泡(apoptotic vesicles, apoVs)通过钙网蛋白(calreticulin,CRT)靶向肝巨噬细胞,调控其迁移极化从而治疗2型糖尿病(type 2 diabetes, T2D)。该研究解析了干细胞治疗系统性疾病的新机制,促进了基于囊泡的新型治疗策略的建立。
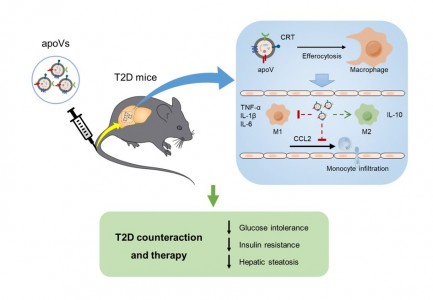
T2D是一类发生广泛、难以治愈的慢性代谢性疾病。MSCs在细胞治疗领域具有广阔的应用前景,在T2D治疗中具有良好疗效。一直以来,MSCs移植后如何发挥治疗作用是研究者们关注的热点问题。本研究前期发现证实,MSCs移植进入宿主体内后会很快地发生凋亡,并释放大量囊泡,但这些凋亡情况下释放的囊泡有何具体作用尚不清楚。在这项研究中,研究人员直接在体外诱导MSCs凋亡并分离提取了凋亡囊泡,将其命名为apoVs并进行了鉴定。研究人员发现,MSCs来源apoVs系统输注可以有效减轻高脂饮食诱导的T2D小鼠糖耐受异常、胰岛素抵抗和肝脏脂肪化,提示MSCs治疗中释放的apoVs是介导其疗效的关键。
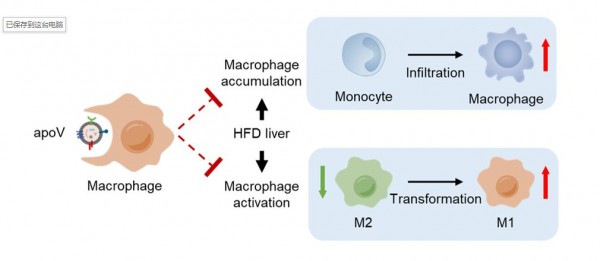
巨噬细胞功能异常导致慢性炎症是促进T2D发生发展的重要病理因素。本研究中,研究人员首先通过示踪,发现肝巨噬细胞是体内摄取apoVs的重要靶细胞。进一步,研究人员利用RNA-seq技术证实,apoVs可以调控巨噬细胞基因谱表达变化,提示巨噬细胞对apoVs的摄取产生了功能性效应。肝巨噬细胞包括组织定居的库普弗细胞(kupffercells, KCs)和外周募集的单核细胞来源巨噬细胞(monocyte-derivedmacrophages, MoMFs)。研究人员发现,apoVs在治疗高脂饮食诱导的T2D过程中,抑制KCs分泌趋化因子、减少MoMFs的募集,并调控KCs和MoMFs表型从促炎向抗炎转化以改善机体慢性炎症,从而治疗肝脏胰岛素抵抗和脂肪病变。
在分子机制层面,目前已知巨噬细胞将凋亡细胞清除的过程称为“胞葬作用”,而介导apoVs摄取的机制仍不清楚。在这项研究中,研究者首先采用多种手段,共同明确了“胞葬作用”重要分子钙网蛋白(CRT)存在于apoVs表面。进一步使用中和抗体和基因表达干预抑制CRT后, apoVs的吞噬以及apoVs对巨噬细胞的调控和对T2D的治疗都受到了显著抑制。上述功能干预实验,揭示了CRT是介导巨噬细胞吞噬apoVs以及apoVs发挥调控和治疗效应的关键分子。
金岩教授团队长期从事干细胞及其细胞外囊泡的生物学功能和工程化研究,在组织工程与再生医学领域取得多项里程碑式科学发现,相关成果在Cell Metabolism、Nature BiomedicalEngineering、Science Translational Medicine等国际权威杂志发表。施松涛教授团队长期引领国际干细胞的基础和应用研究,并在细胞凋亡和凋亡囊泡领域的研究中取得了多项原创性科学发现。
在本研究中,金岩教授、施松涛教授、空军军医大学口腔医院刘世宇副教授为论文的共同通讯作者,空军军医大学博士研究生郑晨曦、空军军医大学博士后隋秉东、北京大学口腔医院主治医师张晓为论文的共同第一作者。
图2 apoVs系统输注治疗T2D示意图
参考文献:
Zheng C, Sui B, Zhang X, Hu J, Chen J,Liu J, Wu D, Ye Q, Xiang L, Qiu X, Liu S, Deng Z, Zhou J, Liu S, Shi S, Jin Y. Apoptotic vesicles restore liver macrophage homeostasis to counteract type 2 diabetes. JExtracell Vesicles. 2021 May;10(7):e12109. Epub 2021 May 24. PMID:34084287