近日,Nature Reviews Materials杂志(影响因子71.189)上发表comment,概述了细胞外囊泡和合成纳米颗粒在药物递送方面的应用。

自1990年代以来,合成纳米颗粒已广泛用于临床药物递送。设计纳米递送策略可以改善治疗剂在体内的时空分布,这可使副作用降低和/或治疗功效提高。通过优化纳米载体的尺寸、形状和表面特性,改善递送。然而,复杂的分子靶向策略在临床试验中屡屡失败。例如BIND-014,它是一种具有表面配体的聚合物纳米颗粒,可与富含前列腺特异性膜抗原(PSMA)的肿瘤结合。靶向配体的纳米递送方法的临床失败部分归因于纳米颗粒与生物环境之间的复杂相互作用,包括形成可以掩盖表面配体并触发免疫学识别的蛋白质电晕。这种相互作用在临床前研究中可能并不明显,因为人和动物模型之间蛋白质电晕的主要成分(例如补体蛋白)存在很大差异。另外,配体类型、取向、密度和表面图案对于最佳递送和与靶分子的结合至关重要。因此,通常需要计算工具来了解设计参数如何影响纳米-生物相互作用。
市场上大多数纳米药物是简单的脂质体。尽管脂质体在临床上用于递送多种治疗剂,包括小分子、肽和RNA,但实现纳米递送以改善患者预后的真正潜力仍在等待更复杂的多功能设计的实现。药物输送系统的优化设计可能需要一定程度的复杂性,类似于生物环境的复杂性,以克服各类障碍,包括清除、降解和物理障碍(例如内皮和细胞膜)。此外,针对特定部位的递送,可确保有利的时空药物作用。然而,尚不确定在合成纳米递送系统中成功整合多种功能成分是否可以与具有成本效益和时间效率的临床级制造工艺兼容。细胞外囊泡(EVs)是细胞释放的天然纳米颗粒。EVs的大小、形状和结构类似于脂质体,但具有更复杂的双层结构,包含多达数百种不同的脂质、蛋白质和碳水化合物类型,以及内部货物和与表面分子(图1)。EVs在各种(病理)生理过程中,在短距离和长距离的细胞间通讯中起着重要作用。EVs将生物分子运输到受体细胞的能力使其在药物输送方面具有吸引力。EVs可以从培养细胞的条件培养基中或从生物组织或液体中获得,并且各种方法(例如电穿孔、挤压和超声处理)已用于将治疗剂加载到EVs中。通过开发用于体内分子货物运输的EV,可以绕开纳米医学的多个设计和制造挑战。然而,由于EV分离和表征方面的挑战,EV在药物递送中的潜力仍然不确定,这阻碍了基础研究和转化研究。尤其是,EV类型之间的异质性以及其他具有重叠特征的生物纳米颗粒的存在使EV的分离变得困难。此外,就生物相容性和部位特异性递送而言,应谨慎过早将EV描述为优于合成纳米颗粒的药物载体。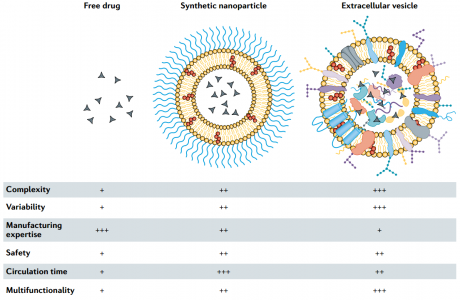
图1.游离药物、临床获批的合成纳米颗粒和细胞外囊泡的特征。低(+)、中(++)和高(+++)。纳米药物面临的挑战是巨噬细胞介导的从循环中肝清除合成纳米颗粒。纳米载体在肝脏中的清除阻碍了特定部位的递送,例如基于大小和形状的纳米载体靶向肿瘤。许多临床上获批的合成纳米颗粒已经用聚乙二醇(PEG)进行了功能化,从而减少了巨噬细胞的摄取,并将循环半衰期从数小时延长至数天。PEG的使用也有一些缺点;基于EV的药物递送可作为避免免疫清除的替代策略。但是,多项研究表明,全身注射的EV也能被肝脏快速清除,并且循环半衰期只有几分钟。EV的分离、药物装载和标记程序有可能使EV更容易被巨噬细胞快速摄取。但是,对EV报告老鼠的一项研究表明,心脏E主要在胸腺、睾丸、肺和肾脏中积累,肝脏吸收较少,这表明体内形成的天然EV可能会经历较少的肝清除。此外,尚不清楚EV生物发生、细胞起源和生物分子组成如何影响药代动力学。某些EV类型的血液循环半衰期长和/或具有针对特定部位的靶向机制,从而克服肝清除。就适当的EV分离、鉴定和表征而言,实验设计对于评估EV作为药物载体的潜力至关重要。与合成纳米颗粒的直接比较通常被省略;然而,如果能做一些比较,这将使我们能够从药物毒性和功效方面确定EV递送的好处。除了可能优于合成载体的生物分布特征外,基于EV的药物递送还有另一个好处——利用细胞过程进行药物加载和表面修饰的可能性。可以对细胞进行基因工程改造,使其在EVs中表达和包装基于蛋白质和RNA的治疗剂和/或靶向配体。由于RNA和蛋白质在纳米颗粒合成过程中可能降解或被破坏,因此将细胞机器用于药物负载和EV表面修饰可能是有利的。另外,EV内吞途径或与受体细胞膜的融合事件可促进细胞内递送,即,将治疗剂靶向特定的细胞内区室或细胞器。在最近的一项研究中,对细胞进行了基因工程改造,以丰富EV中的特定小干扰RNA(siRNA),与合成脂质纳米载体相比,这导致向小鼠的功能性siRNA递送提高了十倍以上。EV载体的优越性归因于siRNA逃逸溶酶体并定位于细胞质中的能力。值得注意的是,siRNA介导的敲低效率取决于EV来源和受体细胞类型。某些细胞类型(例如常驻巨噬细胞)积累了高水平的EV递送siRNA,但显示出最小的靶基因敲低。这些结果表明,就生物分布和细胞内递送而言,必须考虑EV异质性。纳米药物通常比游离药物产生更少的副作用,这是由于健康组织较少接触治疗剂,并且不需要使用有毒赋形剂来溶解非水溶性小分子。实际上,几种纳米药物已经获得了基于等效功效的临床批准,但是与游离给药的小分子相比,其安全性得到了提高。然而,含有PEG的经临床批准的纳米颗粒可以激活补体系统,在极少数情况下,会导致威胁生命的超敏反应,通常可通过降低输注速度来缓解这种反应。基于EV的疗法尚未获得临床批准,但是早期临床试验已经评估了自体树突状细胞衍生的EV对癌症免疫疗法的影响,以及同种异体间充质干细胞的EV在再生和消炎应用中的作用。这些试验中的大多数都报告了轻度至中度的副作用,通常认为施用EV是安全的。已经提出同种异体EV构成风险,因为它们可能引起受体的免疫反应。但是,血液和血浆中也含有高浓度的EV(估计每毫升高达1010个EV),这些EV会从体内所有细胞类型释放到循环中。确实,血浆和输血很少会引起不良的免疫反应,这表明同种异体EV不太可能带来安全风险。然而,与自体EV相比,同种异体EV的缺点可能是肝脏清除速度加快。此外,尽管临床试验的初步安全性结果令人鼓舞,但要在不损坏EV结构的情况下将其取出具有挑战性的内源货物可能会引发不良后果。但是,内源性货物也可能有助于加性或协同作用,特别是如果从具有治疗特性的细胞(例如间充质干细胞)获得EV,则尤其如此。当前,有超过50种临床批准的纳米药物,所有这些药物均基于包含少量成分的简单设计。具有数百个功能组件的生物结构的更复杂纳米颗粒的合成不太可能与大规模的临床级制造兼容。EVs是实现多管齐下和多功能药物载体的有前途的替代品。除了确定EV具有良好递送特性之外,还需要克服制造和规模扩大方面的挑战,包括细胞培养的可变性,这是EV的主要来源。永生化细胞系的使用可使变异性最小化,但可能会带来安全隐患,因为永生化剂可能会装载到EVs中。进一步需要大规模培养,例如搅拌罐或固定床生物反应器,以及化学成分确定的培养基或不含异种补充剂的培养基,例如人血小板裂解物,其裂解物材料对治疗效果的影响应该考虑。EV模拟物也可以通过挤压或超声处理破坏细胞而形成;但是,此过程可能会影响膜的拓扑结构。血小板和红细胞可能是EV模拟物特别合适的来源,因为它们缺乏核物质,核物质可能会成为免疫系统的危险信号。代替细胞培养,可以将人体组织和体液用作EV的来源。实际上,已经证明了从人血浆中大规模临床生产生物纳米颗粒的方法,例如,用于数千名参与者的脂蛋白治疗试验。然而,生物体液和组织与条件细胞培养基相比组成更为复杂,因此从其中分离EVs具有挑战性。对于某些应用,可能不需要高纯度的EV制剂,如果去除了辅助因子,功效甚至可能下降。例如,从伽玛射线照射的外周血单核细胞获得的分泌蛋白组比单独的EV组分显示出更高的治疗功效。在其他情况下,可能有必要将EV与干扰EV功能和载药量甚至产生有害作用的成分分开。监管机构仍在确定哪种类型的标准适用于基于EV的产品。只要预先确定的理化和效能测试可以验证批次之间的一致性和功效,其他生物成分的存在并不一定是监管障碍。最后,已经研究了非人类EV的来源,例如牛奶、水果和藻类,但由于静脉注射可能产生免疫反应,因此其应用受到限制。临床试验中的治疗用EV通常通过超速离心(包括差速和密度)和切向流过滤进行分离。但是,大多数基于EV的临床试验仅涉及少数参与者,并且超速离心可能无法扩展用于更大的研究和商业生产。此外,基于超速离心的方法可能会导致EV损坏和聚集。切向流过滤与大规模生产兼容,并且在保持EV结构的同时实现了体积减小和部分净化。净化后,可以通过装载治疗剂(已报道了临床级方案)或通过与合成纳米颗粒融合来进一步设计EVs。大多数临床试验都使用盐水或蔗糖冷冻保护剂缓冲液将EV储存在-80°C。或者,冻干可能适用于某些EV的货物和功能,并允许简化的存储、分配和即时医疗服务使用。合成纳米医学与EV领域之间越来越多的对话与协作,有可能推动新兴EV生物学与数十年来在合成药物递送临床失败和成功方面的专业知识的成功融合。Witwer,K.W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nature Reviews Materials (2021). DOI: 10.1038/s41578-020-00277-6外泌体资讯网 71分Nature子刊:药物递送——细胞外囊泡vs合成纳米颗粒






