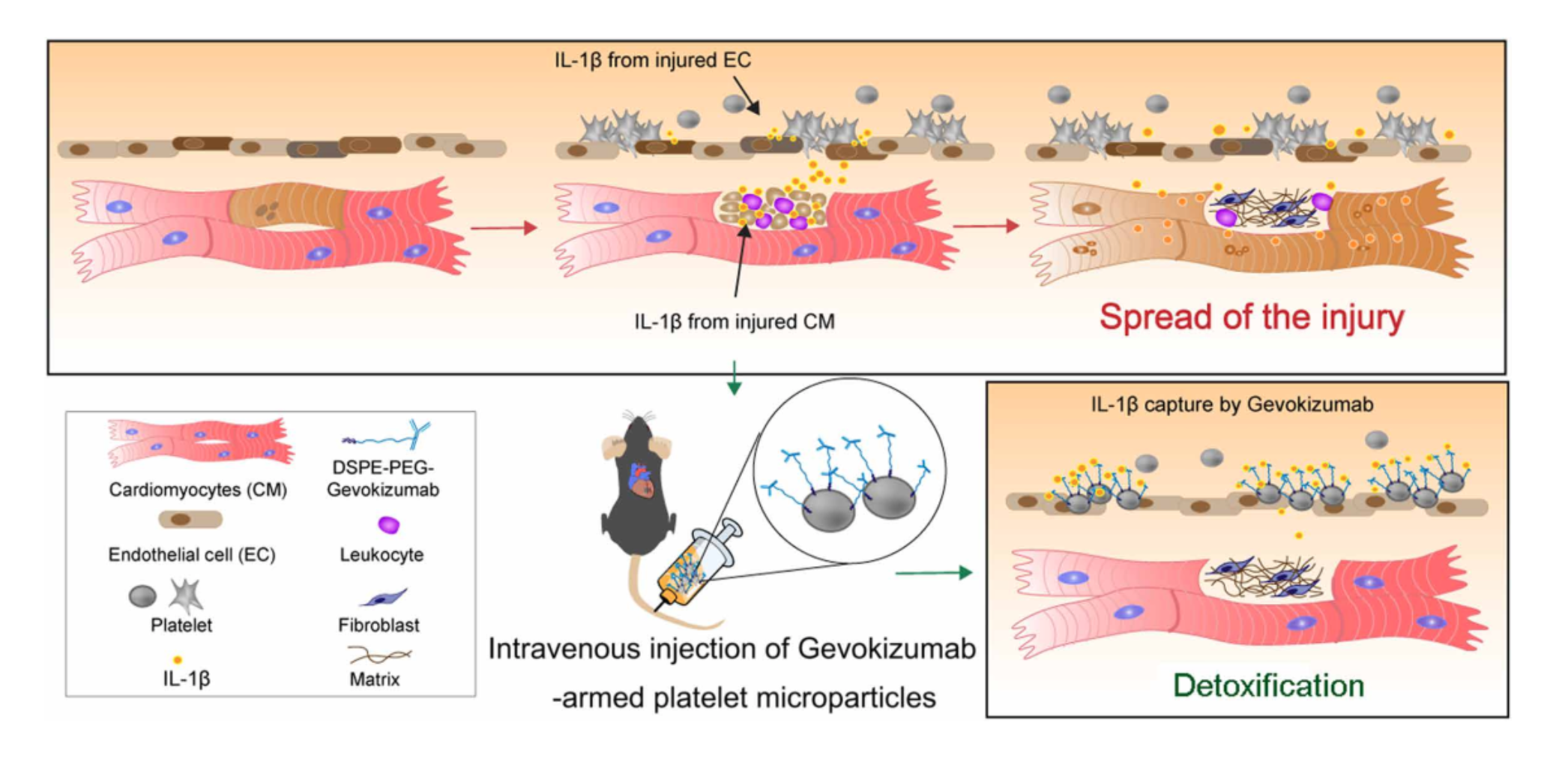
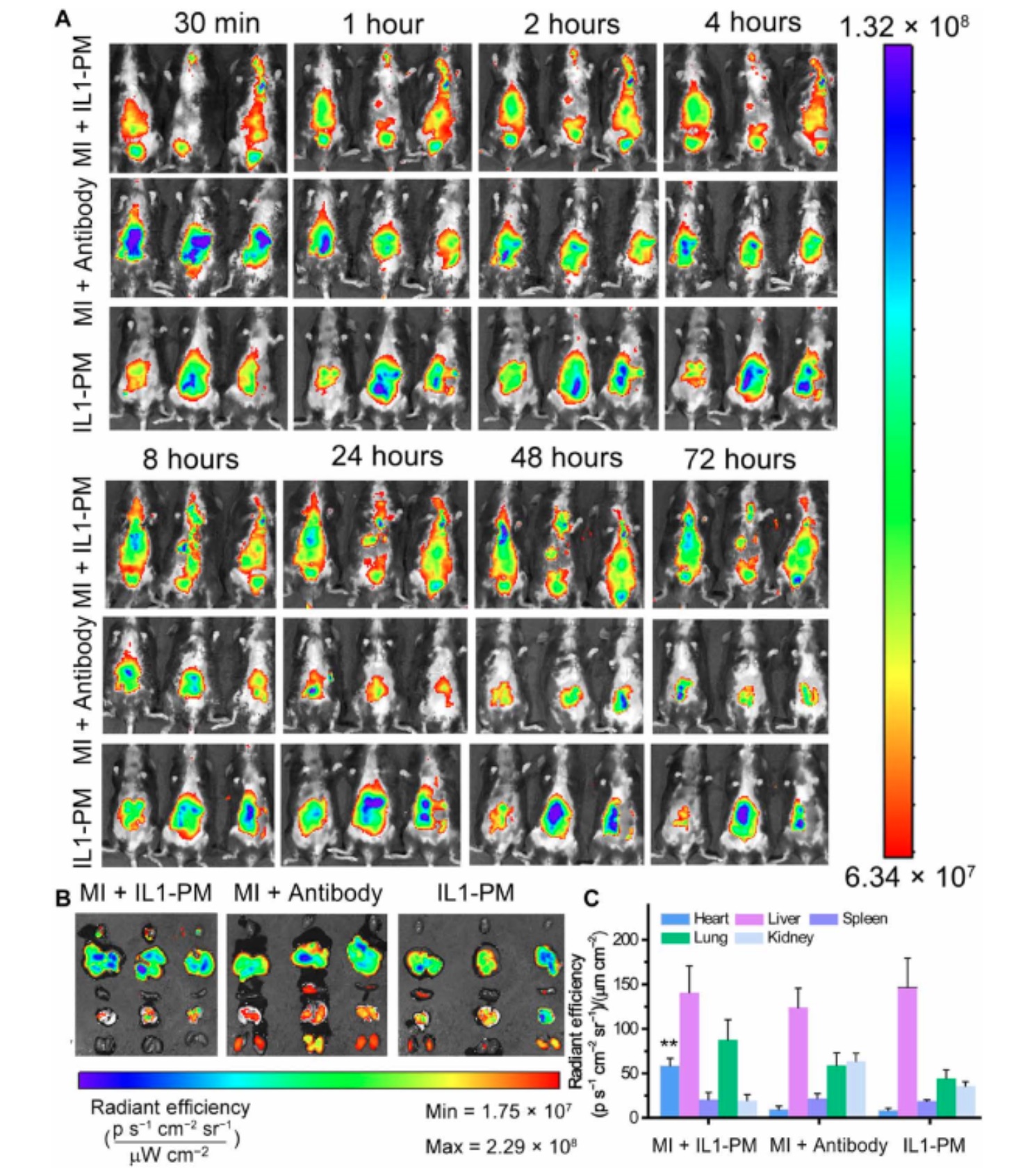
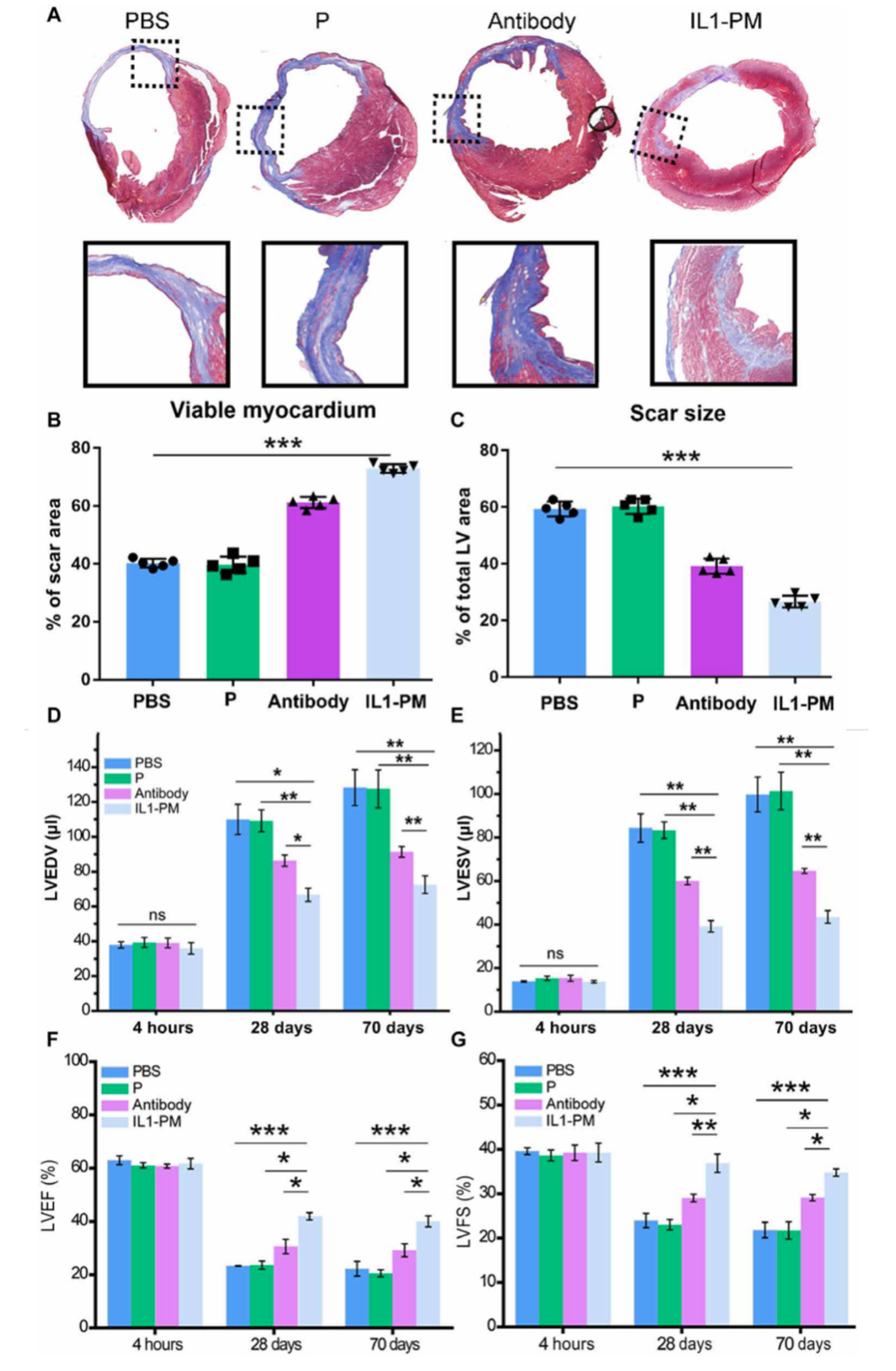
急性心肌梗死(AMI)会诱发无菌炎症反应,从而进一步加剧心脏损伤并促进不良的心脏重塑。白细胞介素-1(IL-1)在由AMI引起的无菌炎症反应中起着核心作用。因此,IL-1β阻断是治疗AMI的有希望的策略。但是,常规的IL-1β阻断剂静脉注射全身给药的这种方式,会在全身无差别阻碍IL-1β的功能,这增加了严重副作用的风险。为了解决此问题,来自北卡罗莱纳州立大学的程柯教授团队制备了带有抗IL-1β抗体的血小板微粒(platelet microparticles, PM),以中和AMI后的IL-1β,并防止不良的心脏重塑。研究结果表明,靶向梗死区域的PMs可能与受伤的心脏结合,从而增加了其中抗IL-1β抗体的数量。抗IL-1β血小板PMs(IL1-PMs)通过中和IL-1β和降低IL-1β驱动的caspase-3活性来保护心肌细胞免于凋亡。该研究发现表明,IL1-PM是一种有前途的心脏排毒剂,可在AMI期间去除细胞毒性IL-1β,并诱导治疗性心脏修复。急性心肌梗死(AMI)主要由冠状动脉闭塞引起,是全世界死亡和致残的主要原因。MI导致流向心肌的血流量减少,并导致心肌坏死。心肌坏死触发无菌性炎症反应,导致不良的左心室重构和心力衰竭。因此,抑制炎症反应可作为预防不良心脏重塑和最终心力衰竭的有效策略。在免疫反应过程中,炎症小体密切调节caspase-1的激活,该酶主要负责处理和激活强大的促炎细胞因子,例如白介素-1β(IL-1β)和IL-18。在这些促炎细胞因子中,IL-1β通过促进其他促炎细胞因子的合成,激活纤维化途径和促进心肌细胞凋亡,在由MI引起的无菌炎症反应中发挥重要作用。对IL-1β作为治疗靶点的兴趣导致了几种干扰IL-1β信号传导的IL-1β抑制剂的发展。这些抑制剂包括IL-1受体拮抗剂、抗IL-1β中和抗体和诱饵受体。但是,目前没有一种IL-1β抑制剂被批准用于MI患者的临床应用。其中包括Canakinumab(Ilaris),这是一种IL-1β抗体,于2017年进入临床阶段。缺乏成功的临床候选药物的主要原因之一是IL-1β抑制剂的安全性风险高。由于缺乏组织/器官靶向能力,IL-1β抑制剂的应用可能会增加致命感染的风险,这会抑制人体对感染的局部和全身炎症反应。为了克服这些局限性,该研究向IL-1β受体抑制剂引入了一个靶向基团,以增强它们在疾病部位的聚集,降低副作用的风险,并提高治疗效率。在该研究团队以前的研究中,证明了通过利用血小板膜装饰干细胞和颗粒来针对受损心脏进行有针对性的修复,可以利用血小板膜的自然梗塞归巢能力。受这些发现的启发,该研究开发了一种使用抗IL-1β中和抗体的血小板模拟系统。该系统起着IL-1β诱饵的作用,有针对性地减少了受伤心脏的局部炎症反应。为了捕获IL-1β,使用了有效的单克隆抗体Gevokizumab。Gevokizumab(也称为XOMA 052,由XOMA Corporation开发)是一种抗炎剂,已在临床试验中用于治疗寻常痤疮、骨关节炎、Bechet病及其伴发的葡萄膜炎、坏疽性脓皮病。首先使用1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-聚乙二醇(DSPE-PEG)衍生物对其进行了修饰,以结合血小板。利用血小板的梗死部位归巢能力,IL-1β诱饵将通过循环运输到MI区域,在该区域中和IL-1β,从而防止不良的心脏重塑和最终的心力衰竭。这项研究将为在MI治疗中利用IL-1β抑制剂发挥治疗作用创造新的可能性。IL1-PMs在急性MI小鼠中的生物分布。(A)在静脉内注射IL1-PM@Cy5.5或抗体@ Cy5.5后,MI小鼠或对照小鼠在不同时间间隔的体内荧光成像。(B)从处理的动物中切除的主要器官的离体荧光成像。(C)器官中荧光强度的定量分析。抗体,Gevokizumab;IL1-PM,带有Gevokizumab的血小板微粒。**P <0.01表明用IL1-PM@Cy5.5处理的MI组与其他组有显著差异。IL1-PM处理可减轻心脏重塑。(A)处理后70天,心肌切片的Masson染色代表图。根据Masson图对(B)存活心肌和(C)疤痕大小进行定量分析。在处理后4小时、28天和70天通过超声心动图测量(D)LVEDV和(E)LVESV。(F)LVEF和(G)LVFS在基线(心梗后4小时)、处理后28天和70天时通过超声心动图测量。作者最后指出在这项工作进行转化应用之前,需要做更多的研究。首先,由于活化的血小板会引起聚集,因此我们需要在使用前使分离的血小板保持灭活状态。其次,在过去的几十年中,研究人员开发出了针对各种炎症途径的疗法,例如可选择性裂解C5成分的pexelizumab、抑制P-selection的抗P-selection单克隆抗体和Canakinumab可以阻断IL- 1β。但是,大多数抗炎策略在临床试验中均失败。失败的可能原因是脱靶效应和不适当的给药时间。第三,在这项工作中,如数据所示,使用具有高嫁接效率的DSPE-PEG连接子将抗体插入血小板中。尽管如此,仍需要在改善血小板和脂质修饰的抗体的纯度上进行进一步的努力,以保持可接受的批次装载效率。此外,值得一提的是,该靶向策略基于血小板平台,该平台是具有高度不稳定性和污染风险的生物制剂。但是,在当前的医学实践中,经常输血或输血小板。因此,可以控制使用血小板衍生物的风险。通过开发不依赖使用活血小板的靶向策略(例如使用血小板结合分子进行靶向)来进一步微调该系统将会有所帮助。第四,由于体内成像系统(IVIS)的半定量性质,未来的药代动力学研究应使用更多定量方法,例如PET来确定各个器官中IL1-PM的实际数量。此外,在临床上,大多数急性心肌梗死患者将接受经皮冠状动脉介入治疗,然后接受其他治疗。因此,LAD结扎模型不能完美模拟患者的临床状况,而缺血/再灌注(I/R)模型可能更适合于MI的研究。因此,将来,应该将大小动物的I/R模型用于MI的研究。Li Z, Hu S, Huang K, Su T, Cores J, Cheng K. Targeted anti-IL-1β platelet microparticles for cardiac detoxing and repair. Science Advances. 2020 Feb 5;6(6):eaay0589. doi: 10.1126/sciadv.aay0589. eCollection 2020 Feb.
外泌体资讯网 Science子刊:利用血小板的损伤部位归巢能力,开发出血小板微粒+IL-1β抗体药物靶向受损心脏新方法