作者:企鹅
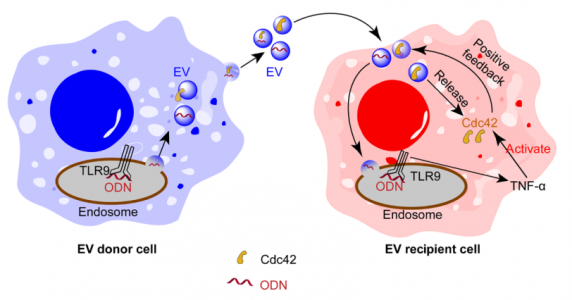
内体Toll样受体(TLRs)通过识别DNA和RNA序列介导细胞内先天免疫。最近的研究报道,参与转移各种核酸的细胞外囊泡(EV)在摄取TLR激活分子中的作用,引发了对EV在先天免疫监视中可能发挥作用的猜测。然而,EV介导的摄取是否是一种普遍的机制尚未明确;可能涉及的分子机制也尚不清楚。来自清华大学药学院的尹航教授最新发表在Science Advances杂志(影响因子12.804)的研究表明,当用TLR9激动剂CpG寡脱氧核苷酸(ODN)刺激巨噬细胞时,分泌的EVs将ODN转运到幼稚巨噬细胞中并诱导趋化因子TNF-α的释放。此外,这些EVs将Cdc42转移到受体细胞中,导致其细胞摄取的进一步增强。通过EVs将TLR9激活的巨噬细胞中的ODN和Cdc42转运至幼稚细胞在细胞内免疫应答的传播中发挥协同作用,揭示了一种EVs介导的病原体相关分子模式的摄取的通用机制。
细胞内先天免疫引起了广泛的研究关注,尤其是关键介质,如内体Toll样受体(TLRs)、环鸟苷5'-单磷酸腺苷-5'-单磷酸合酶、以及细胞溶质先天免疫中干扰素基因的刺激物。感应来自病原体的DNA和RNA。人类TLR是一个重要的先天免疫受体家族,位于细胞表面(TLR1、TLR2、TLR4、TLR5、TLR6和TLR10)或内体区室内的细胞内(TLR3、TLR7、TLR8和TLR9),能够识别病原体相关分子模式(PAMPs)和危险相关分子模式(DAMPs)。有趣的是,最近在通过促进脂多糖(LPS)的摄取诱导先天免疫激活中发现了涉及细菌来源的细胞外囊泡(EV)的机制,脂多糖是细胞表面上TLR4的典型PAMP。在EVs的帮助下,LPS穿透细胞膜并激活细胞溶质中的各种炎症性caspases。尽管如此,关于其他PAMP/DAMP是否也使用类似的EVs途径或涉及哪种分子机械仍知之甚少。
在不同的病理和生理过程中,EVs在细胞-细胞通讯中发挥关键作用。供体和受体细胞之间EVs的传递是分子(包括蛋白质、核酸和脂质)转移的重要手段,而这些特定分子又可能对EVs细胞摄取产生影响。最近的一项研究表明,癌细胞的转移能力可以决定EV受体细胞的吸收效率。研究结果表明,与来自原发性恶性细胞的EVs相比,从转移性位点来源的PC-3细胞分离的EVs更有效地内化到受体细胞中。免疫细胞分泌的EVs显示出免疫调节能力。在免疫应答中,细菌抗原感染后巨噬细胞分泌的EVs在体外和体内均诱导树突状细胞和T细胞的活化。
尽管EVs参与介导免疫应答,但EVs在不同PAMP细胞内化中的作用和细胞内先天免疫的激活值得进一步研究。该报道研究了EVs是否运输PAMP/DAMP分子,并随后影响靶细胞功能。研究结果表明,TLR9配体CpG寡脱氧核苷酸(ODN)被EVs从受感染的巨噬细胞转运到幼稚巨噬细胞中,这表明EVs利用寡核苷酸PAMP作为货物在细胞内和细胞间先天免疫发挥调节作用。同时,与来自未感染细胞的EVs相比,观察到来自ODN感染的巨噬细胞的EVs的细胞摄取增加。机制上,EVs运输Cdc42,一种负责增加细胞内吞活性的蛋白质。此外,由EVs携带的ODN诱导肿瘤坏死因子-α(TNF-α)的释放,其进一步激活Cdc42以促进EV的细胞摄取。总之,这些结果揭示了EVs促进不同PAMP/DAMP进入受体细胞的通用机制。这些发现不仅揭示了先天免疫的激活,而且还提出了以前未明确的这些重要生物学途径的调控策略。
EV在巨噬细胞间传递免疫反应的作用机制示意图
总之,该研究发现揭示EV通过其自身细胞摄取的反馈调节传播TLR9介导的先天免疫应答的机制。对携带ODN的EV的摄取的研究可以加深对EV在TLR调节的细胞内先天免疫应答中的作用的理解。先前已报道过多种机制,用于解释细胞内吞作用后内吞EV及其货物的命运。尽管如此,诸如EV中核酸货物的拓扑结构之类的有趣问题仍未得到解决。彻底描述ODN如何以及何时从EV释放并因此与TLR9相互作用需要进一步研究。此外,该研究结果可能有助于开发更有效的靶向Cdc42的治疗方法,以调节EV的摄取,特别是在各种炎性疾病的背景下。
参考文献:
Ying Zhang, Xue Jin, Jiaqi Liang, Yilan Guo, Gaoge Sun, Xianfeng Zeng and Hang Yin. Extracellular vesicles derived from ODN-stimulated macrophages transfer and activate Cdc42 in recipient cells and thereby increase cellular permissiveness to EV uptake. Science Advances 24 Jul 2019: Vol. 5, no. 7, eaav1564 DOI: 10.1126/sciadv.aav1564