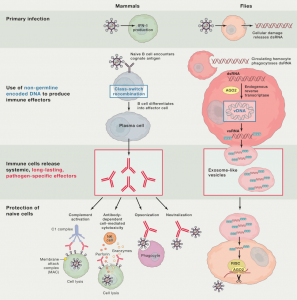
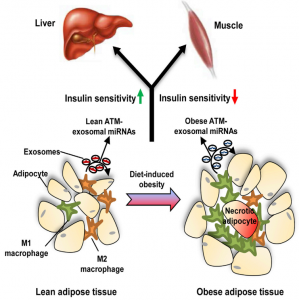
截止目前,发表在Cell杂志的外泌体文献共有22篇,其中17篇研究性文章,5篇综述/评述性文章。总数上,在CNS中是最多的(Nature 13篇;Science 9篇)。Cell杂志发表的这些文章中细菌、寄生虫等相关的最多,肿瘤相关的也有好几篇。其他方面值得留意的是第一篇外泌体的开山鼻祖、Cre-LoxP系统在体追踪外泌体、脂肪组织巨噬细胞外泌体miRNAs调节胰岛素敏感性等。
1. Pan, B. T. and R. M. Johnstone (1983). "Fateof the transferrin receptor during maturation of sheep reticulocytes in vitro:selective externalization of the receptor." Cell 33(3): 967-978.
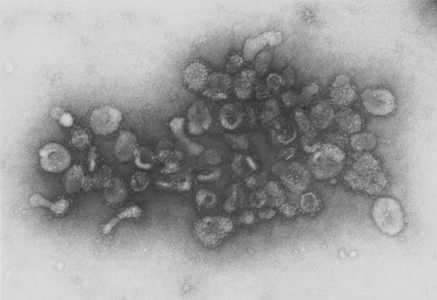

这是外泌体研究的最最最原始的第一篇文献。在外泌体的发现历史介绍中,我们都会说外泌体于1983年就被Johnstone发现。
该研究使用FITC-和125I-标记的抗转铁蛋白受体的抗体追踪转铁蛋白受体在绵羊网织红细胞体外成熟过程中的命运。用抗转铁蛋白受体抗体标记绵羊网织红细胞,在培养期间释放包含多肽的囊泡,该囊泡在聚丙烯酰胺凝胶上与转铁蛋白受体共迁移。囊泡的形成不需要抗转铁蛋白受体抗体的存在。使用125I-表面标记的网织红细胞,释放的125I-标记的物质被抗运铁蛋白受体抗体的免疫亲和柱保留。使用标记有125I标记的抗转铁蛋白受体抗体的网织红细胞来跟踪囊泡的形成,结果显示,在0摄氏度或在PBS中,囊泡释放速率小于37摄氏度培养物中。抗体-受体复合物具有选择性外部化,因为在外化的囊泡中发现少量其他膜蛋白。抗转铁蛋白受体抗体引起受体重新分布并未表现出对囊泡分泌是必须的。
2. Luga, V., et al. (2012). "Exosomes mediatestromal mobilization of autocrine Wnt-PCP signaling in breast cancer cellmigration." Cell 151(7): 1542-1556.
这是一篇关于外泌体通过介导自分泌Wnt-PCP信号参与乳腺癌迁移的研究性文章。
该研究报告了成纤维细胞分泌外泌体通过Wnt/PCP信号促进乳腺癌细胞(BCC)的突出活动和运动性。研究显示外泌体刺激BCC突起产生呈现PCP复合物,Fzd-Dvl和Vangl-Pk的互斥定位。在乳腺癌原位小鼠模型中,与成纤维细胞共注射BCC显著增强癌细胞转移,这依赖于BCC中的PCP信号和成纤维细胞外泌体的Cd81。此外,研究证明成纤维细胞外泌体动员BCCs中的Wnt11。这项工作揭示了一个细胞间通讯通路,即,成纤维细胞外泌体动员自分泌Wnt-PCP信号驱动BCC侵袭行为。
3. Regev-Rudzki, N., et al. (2013). "Cell-cellcommunication between malaria-infected red blood cells via exosome-likevesicles." Cell 153(5): 1120-1133.
这是一篇关于恶性疟原虫感染中外泌体样囊泡作用的研究性文章。
该研究确定了恶性疟原虫感染的血红细胞通过可递送基因的外泌体样囊泡在寄生虫种群之间直接通信。重要的是,通过外泌体样囊泡的交流促进了分化为性形式的速率,表明有信号涉及。此外,确定了一种恶性疟原虫蛋白质PfPTP2,它在这种有效的通讯中起着关键作用。这项研究揭示了一种以前未知的恶性疟原虫生物学途径,这对其在寄主体内的存活和在蚊子中的传播至关重要。因此,或可通过阻断人类宿主到蚊子的寄生虫传播来开发新的药物。
4. Boelens, M. C., et al. (2014). "ExosomeTransfer from Stromal to Breast Cancer Cells Regulates Therapy ResistancePathways." Cell 159(3): 499-513.
这是一篇关于基质外泌体传递至乳腺癌细胞调节治疗耐受性的研究性文章。
该研究发现,基质细胞和乳腺癌细胞利用旁分泌(paracrine)和近分泌(juxtacrine)信号来启动化疗和放疗的耐受性。在这种复杂的相互作用中,外泌体从基质细胞转移到乳腺癌细胞。外泌体中的RNA成分,大部分是非编码转录本和可转移元件,促进RIG-I受体的识别,从而激活STAT1依赖的抗病毒信号通路。与此同时,基质细胞也能激活乳腺癌细胞的NOTCH3。这种旁分泌的抗病毒作用和近分泌NOTCH3信号通路在STAT1汇合从而促进NOTCH3的转录反应和治疗耐受的肿瘤起始细胞的繁殖。原代人/鼠乳腺癌细胞分析支持抗病毒/NOTCH3信号在NOTCH信号通路和基质介导的耐受中的作用,这种作用能被γ分泌酶抑制剂废除。因此,基质细胞利用外泌体来介导抗病毒信号参与了一个错综复杂的与乳腺癌细胞的相互作用。这能够使乳腺癌耐受治疗并重新起始肿瘤的生长。
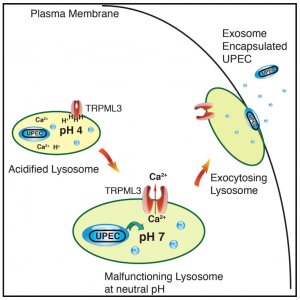
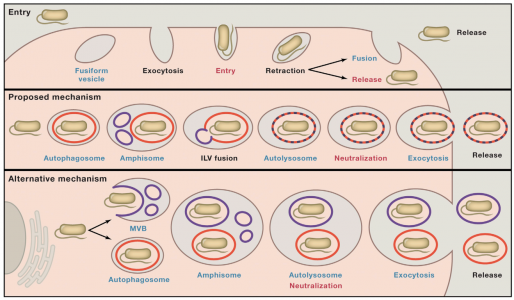
5. Miao, Y., et al. (2015). "A TRP Channel SensesLysosome Neutralization by Pathogens to Trigger Their Expulsion." Cell.

这是一篇关于外泌体参与溶酶体pH被中和后将病原体排出细胞外的研究性文章。
该研究表明,当尿路致病性大肠杆菌(UPEC)感染膀胱上皮细胞(BECs)时,它们被自噬靶向,但由于其中和溶酶体pH的能力而避免降解。粘蛋白TRP通道3(TRPML3)是一种定位于溶酶体的瞬时受体电位阳离子通道,可检测到这种变化。TRPML3激活自发启动溶酶体胞吐作用,导致外泌体包裹的细菌的排出。这些研究揭示了溶酶体稳态的细胞缺陷系统,这已被自主防御程序所采用以清除顽拗性病原体。
6. Sergeeva, O. A. and F. G. van der Goot (2015)."Kicking Out Pathogens in Exosomes." Cell 161(6): 1241-1242.
这是一篇针对上面那篇外泌体参与清除病原体的评述文章。
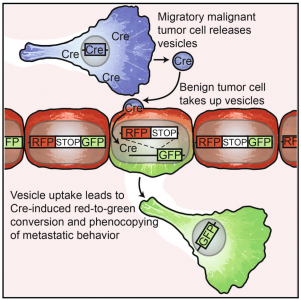
7. Zomer, A., et al. (2015). "In Vivo imagingreveals extracellular vesicle-mediated phenocopying of metastaticbehavior." Cell 161(5): 1046-1057.
这是一篇关于利用Cre-LoxP系统在体追踪细胞外膜泡的研究性文章。
该研究使用Cre-LoxP系统直接鉴定体内接受EVs的肿瘤细胞。研究表明,由恶性肿瘤细胞释放的EVs被位于相同和远处肿瘤内较不恶性的肿瘤细胞摄取,并且这些EVs携带参与迁移和转移的mRNA。活体成像结果表明,摄取了EVs的较低恶性的肿瘤细胞显示增强的迁移行为和转移能力。肿瘤细胞局部和系统地分享EVs携带的分子,并且这会影响靶细胞行为。
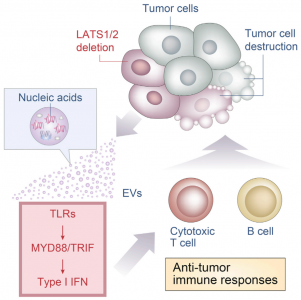
8. Moroishi, T., et al. (2016). "The HippoPathway Kinases LATS1/2 Suppress Cancer Immunity." Cell 167(6): 1525-1539e1517.
这是一篇关于Hippo通路激酶LATS1/2抑制肿瘤免疫的研究性文章。其中涉及缺失LATS1/2的肿瘤细胞胞外囊泡通过TLRs-MYD88/TRIF途径诱导I型IFN反应。
该研究发现Hippo通路在抑制抗肿瘤免疫中有意想不到的作用。研究证明,在三种不同的小鼠同源肿瘤模型(B16、SCC7和4T1)中,肿瘤细胞Hippo通路激酶LATS1/2(large tumor suppressor 1和2)的丢失抑制肿瘤生长。LATS1/2缺失的肿瘤抑制与适应性免疫反应相关,并且LATS1/2缺陷增强肿瘤疫苗的功效。机制上,无LATS1/2的肿瘤细胞分泌富含核酸的胞外囊泡,通过Toll样受体-MYD88/TRIF途径诱导I型干扰素反应。因此,肿瘤中LATS1/2的缺失增强肿瘤免疫原性,通过促进抗肿瘤免疫反应从而最终导致肿瘤被破坏。该研究发现了Hippo通路在调节肿瘤免疫原性中的关键作用,并证明了在癌症免疫治疗中靶向LATS1/2的概念。
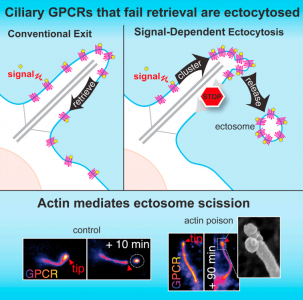
9. Nager, A. R., et al. (2016). "An Actin NetworkDispatches Ciliary GPCRs into Extracellular Vesicles to ModulateSignaling." Cell.
这是一篇关于GPCRs通过纤毛释放到ectosome中的研究性文章。
该研究发现当激活的G蛋白偶联受体(GPCR)未能通过BBSome介导由纤毛回到细胞时,这些GPCR在通过ectosome释放到细胞外前,会集中到纤毛膜芽的尖端。肌动蛋白actin和肌动蛋白调节剂drebrin和肌球蛋白myosin 6介导其从纤毛尖端的ectosome释放。从纤毛中释放激活的信号分子,这种信号依赖的回收作用(retrieval)、胞吐作用是有选择性和有效的过程。
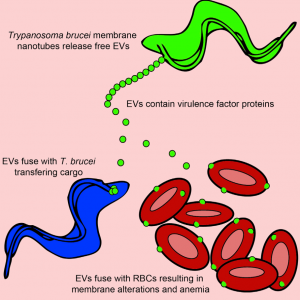
10. Szempruch, A. J., et al. (2016)."Extracellular Vesicles from Trypanosoma brucei Mediate Virulence FactorTransfer and Cause Host Anemia." Cell 164(1-2): 246-257.
这是一篇关于布氏锥虫通过细胞外膜泡传递毒力因子引起宿主贫血症的研究性文章。
该研究发现血流中的非洲锥虫由鞭毛膜产生膜纳米管并分解成游离的细胞外小泡(EVs)。锥虫细胞外囊泡包含几个有毒性的鞭毛蛋白,布氏锥虫罗德西亚亚种的细胞外囊泡包含血清耐药相关蛋白(SRA),此为人感染性所必需。布氏锥虫罗得西亚亚种的细胞外囊泡转移SRA到非人类传染性的锥虫,使其逃避人体先天免疫。锥虫细胞外囊泡还可以与哺乳动物的红细胞融合,造成红细胞被迅速清除,从而导致贫血。这些数据表明,锥虫细胞外囊泡是一种细胞器,可介导非遗传性毒力因子的转移,使宿主红细胞重构,从而导致贫血。
11. Tkach, M. and C. Thery (2016). "Communicationby Extracellular Vesicles: Where We Are and Where We Need to Go." Cell164(6): 1226-1232.
这是一篇Thery大牛的综述文章。
该综述介绍了一些EVs最引人注目的功能,以及我们目前对其生理作用认识的局限。尽管有初步研究表明,EVs在体内具有一些生理功能,但EVs的本质特性仍有待进一步澄清。这篇综述主要关注肿瘤细胞和微环境,但类似的结果和挑战也适用于EVs介导的其他的病理/生理过程。
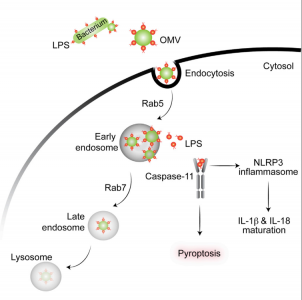
12. Vanaja, S. K., et al. (2016). "Bacterial OuterMembrane Vesicles Mediate Cytosolic Localization of LPS and Caspase-11Activation." Cell 165(5): 1106-1119.

这是一篇关于细菌胞外膜泡传递LPS至宿主细胞浆内产生免疫反应的研究性文章。
该研究发现革兰氏阴性细菌产生的细胞外膜泡(outer membrane vesicles, OMVs)可作为载体递送LPS进入宿主细胞质,在体外和体内实验中触发caspase-11依赖性免疫反应。OMVs通过内吞作用进入宿主细胞质,LPS从早期胞内体释放进入细胞质。使用OMVs生成能力被严重削弱的细菌突变体,揭示了OMVs在介导LPS到胞质的重要性。总的来说,该研究结果表明OMVs在革兰氏阴性细菌感染过程中传递LPS至宿主胞质然后活化caspase-11的关键作用。
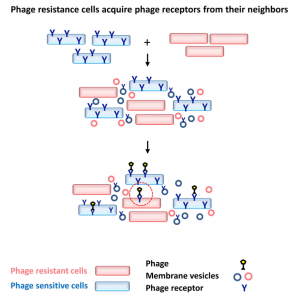
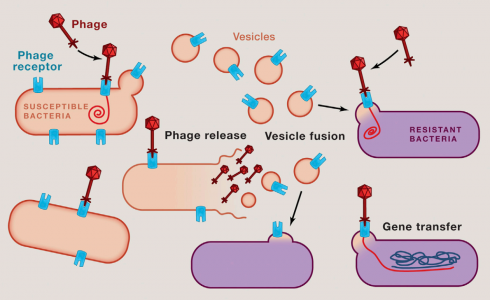
13. Tzipilevich, E., et al. (2017). "Acquisitionof Phage Sensitivity by Bacteria through Exchange of Phage Receptors."Cell 168(1-2): 186-199 e112.
这是一篇关于细菌通过胞外膜泡传递噬菌体受体获得噬菌体敏感性的研究性文章。
14. Ofir, G. and R. Sorek (2017). "Vesicles SpreadSusceptibility to Phages." Cell 168(1-2): 13-15.
这是一篇针对上面那篇噬菌体敏感性传递文章的评述性文章。
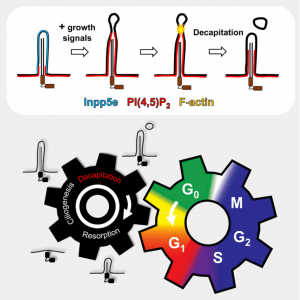
15. Phua, S. C., et al. (2017). "DynamicRemodeling of Membrane Composition Drives Cell Cycle through Primary CiliaExcision." Cell 168(1-2): 264-279 e215.
这是一篇关于膜成分动态重构通过原纤毛的切除促进细胞周期的研究性文章。
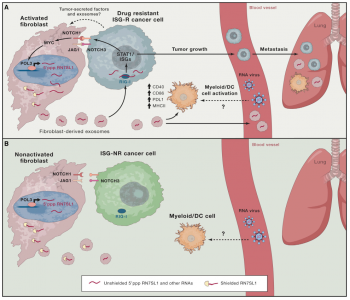
16. Nabet, B. Y., et al. (2017). "Exosome RNAUnshielding Couples Stromal Activation to Pattern Recognition ReceptorSignaling in Cancer." Cell 170(2): 352-366 e313.
这是一篇关于肿瘤细胞迫使基质细胞通过外泌体释放无蛋白结合的RNA RN7SL1促进肿瘤的生长和转移的研究性文章。
该研究表明,乳腺癌细胞触发基质细胞NOTCH-MYC信号通路导致POL3驱动的RN7SL1增加。RN7SL1是一种通常被RNA结合蛋白SRP9/14结合的内源性RNA。RN7SL1的这种增加改变了其与SRP9/14之间的化学计量比例,并在基质外泌体中产生非屏蔽的RN7SL1(小编注:SRP9/14结合时被称为shielded RN7SL1,被屏蔽的RN7SL1;无SRP9/14结合时被称为unshielded RN7SL1,非屏蔽的RN7SL1)。在外泌体转移到免疫细胞后,非屏蔽的RN7SL1触发炎症反应;转移到乳腺癌细胞后,非屏蔽RN7SL1激活PRR RIG-1以增强肿瘤生长、转移和治疗抗性。通过来自患者肿瘤和血液的证据证实,通过部署RNA DAMPs激活基质细胞与非屏蔽RNA的调控协同促进癌症侵袭性特征。
17. Matei, I., et al. (2017). "UnshieldingExosomal RNA Unleashes Tumor Growth And Metastasis." Cell 170(2): 223-225.
这是一篇针对上面那篇外泌体RN7SL1文章的评述性文章。
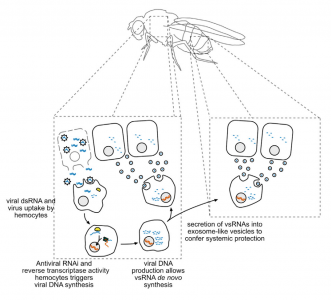
18. Tassetto, M., et al. (2017). "CirculatingImmune Cells Mediate a Systemic RNAi-Based Adaptive Antiviral Response inDrosophila." Cell 169(2): 314-325 e313.
这是一篇关于外泌体介导果蝇抗病毒适应性免疫的研究性文章。
该研究显示果蝇具有由巨噬细胞样血细胞介导的复杂的基于全身RNAi的免疫。血细胞从感染的细胞中摄取dsRNA,通过内源转座子逆转录酶产生病毒衍生的互补DNA(vDNA)。这些vDNA模板从头合成二级病毒siRNA(vsRNA),分泌到外泌体样囊泡中。有趣的是,从感染果蝇的血淋巴中纯化的含有vsRNA的外泌体,在幼稚动物中赋予了针对病毒攻击的被动保护。因此,类似于脊椎动物,昆虫使用免疫细胞产生免疫记忆,其形式是稳定的vDNA,产生由含有vsRNA的外泌体介导的全身免疫。
19. West, C. and N. Silverman (2017)."Drosophilosophical: Re-thinking Adaptive Immunity in the Fly." Cell169(2): 188-190.
这是一篇针对上面那篇果蝇抗病毒适应性免疫文章的评述文章。
20. Ying, W., et al. (2017). "Adipose TissueMacrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro InsulinSensitivity." Cell 171(2): 372-384 e312.
这是一篇关于脂肪组织巨噬细胞外泌体miRNAs调节胰岛素敏感性的研究性文章。
该发现肥胖小鼠中的脂肪组织巨噬细胞(ATMs)分泌含有miRNAs的外泌体,当向瘦小鼠施用这些外泌体时,能够导致其葡萄糖不耐受和胰岛素抵抗。相反,从瘦小鼠获得的脂肪组织巨噬细胞外泌体在施用于肥胖个体时可以改善葡萄糖耐量和胰岛素敏感性。miR-155是肥胖个体脂肪组织巨噬细胞外泌体中过表达的miRNAs之一,早期研究表明PPARγ是miR-155靶标。该研究结果显示,与对照相比,miR-155敲除动物对胰岛素敏感并且耐受葡萄糖。此外,将野生型小鼠骨髓移植到miR-155敲除小鼠中能够减轻该表型。总而言之,这些研究表明,脂肪组织巨噬细胞分泌含有miRNAs成分的外泌体。这些外泌体中的miRNAs可通过旁分泌或内分泌调节的机制转移到胰岛素靶细胞,对胰岛素敏感性和总体葡萄糖平衡具有调节作用。
21. Ashley, J., et al. (2018). "Retrovirus-likeGag Protein Arc1 Binds RNA and Traffics across Synaptic Boutons." Cell172(1-2): 262-274.e211.
这是一篇关于逆转录病毒样Gag蛋白Arc1与RNA结合、可跨越突触“终扣”进行传递的研究性文章。
该研究发现,果蝇Arc1蛋白质形式结合神经元中darc1mRNA的衣壳样结构,并加载到细胞外囊泡中,从运动神经元转移到肌肉。这种加载和转移取决于darc1-mRNA3'非翻译区,其中含有反转录转座子样序列。中断转移会抑制突触可塑性,这表明dArc1与其mRNA复合物的转移对这一功能是必须的。值得注意的是,培养的细胞释放胞外囊泡,其含有与其自身mRNA形成复合物的Copia逆转录转座子的Gag区域。综上所述,研究结果发现了涉及逆转录病毒样衣壳和胞外囊泡的跨突触mRNA转运机制。
22. Pastuzyn, E. D., et al. (2018). "The NeuronalGene Arc Encodes a Repurposed Retrotransposon Gag Protein that MediatesIntercellular RNA Transfer." Cell 172(1-2): 275-288.e218.
这是一篇关于神经元基因Arc编码介导细胞间RNA转移的逆转录转座子Gag蛋白的研究性文章。
该研究显示Arc自组装成封装RNA的病毒样衣壳。内源性Arc蛋白从细胞外囊泡中的神经元释放,介导Arc mRNA向新的靶细胞的转移,在那里它可以进行活性依赖性翻译。纯化的Arc衣壳被内吞,并且能够将ArcmRNA转移到神经元的细胞质中。这些结果表明,Arc显示与逆转录病毒Gag蛋白相似的分子特性。进化分析表明,Arc源自Ty3 / gypsy逆转录转座子的脊椎动物谱系,其也是逆转录病毒的祖先。这些发现表明,Gag逆转录因子在进化过程中被重新用于调解神经系统中的细胞间通讯。
外泌体资讯网 外泌体文献【Cell】合集