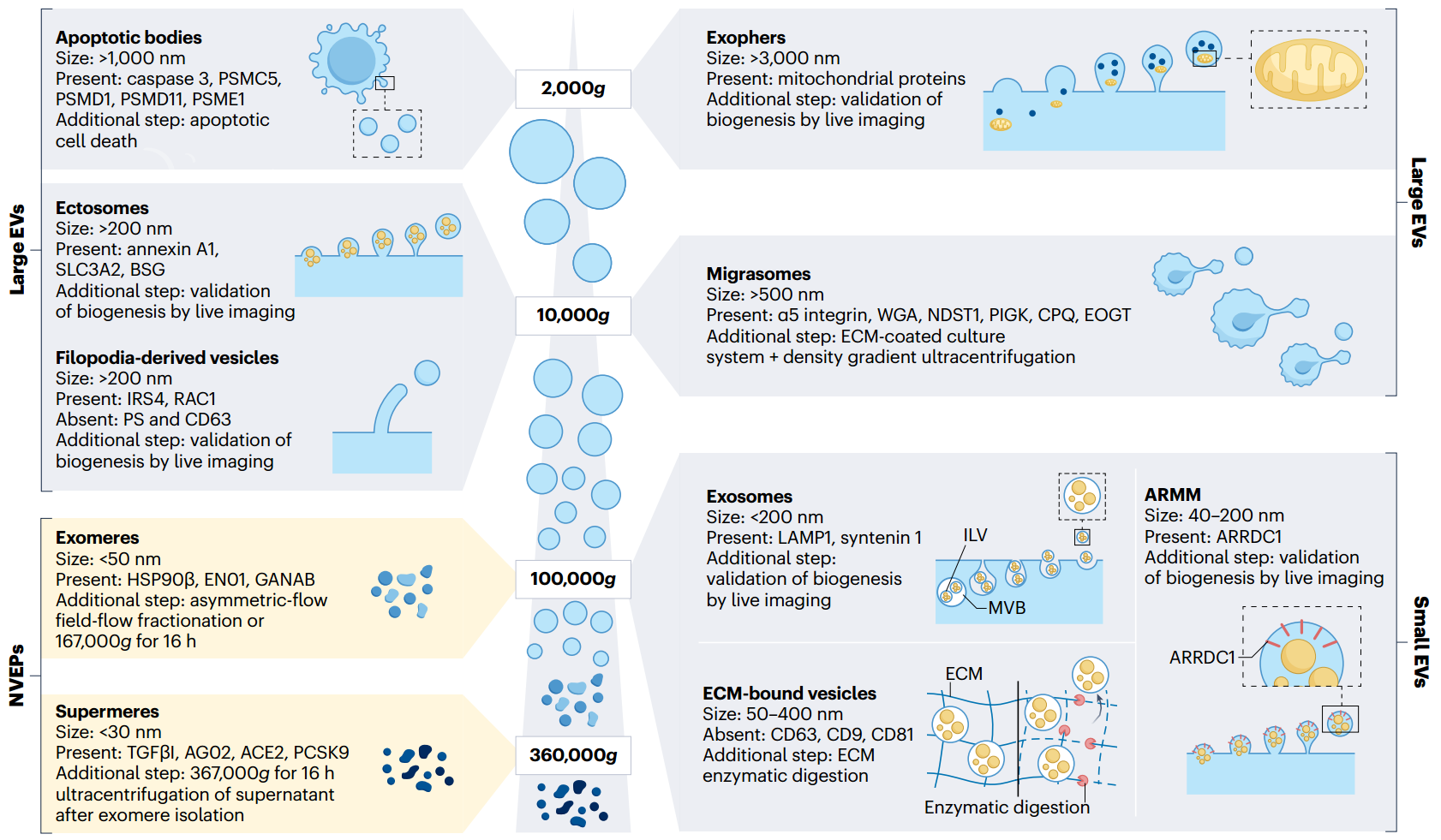
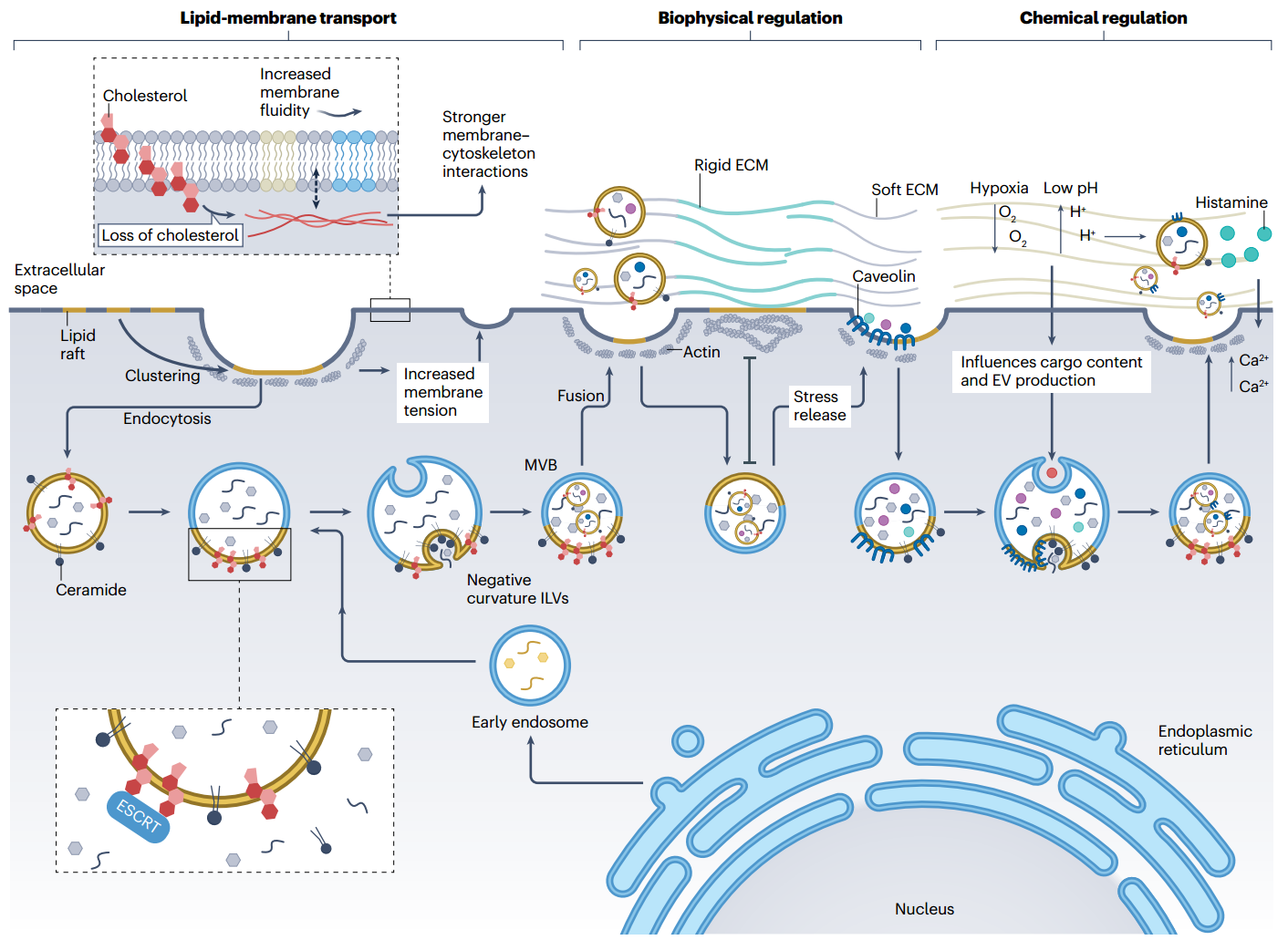
 图2、细胞外囊泡(EV)在细胞外基质(ECM)中的生物发生机制。细胞外囊泡(EV)的生物发生与脂质-膜转运过程以及调节此过程的细胞外基质(ECM)中的物理化学因素密切相关。脂质微团作为多囊体体(MVBs)的前体,通过提供胆固醇和鞘脂等脂质来发挥作用。胆固醇介导内体分选复合物的招募,而鞘脂则诱导负曲率以形成内腔囊泡(ILVs)。在脂质微团的内吞作用期间,膜的丧失可以通过MVB融合期间膜的增加来抵消,从而平衡膜张力。当ECM较软时,脂质微团,包括洞窟小泡,更容易形成,因为它们不用来对抗机械应力。在这种情况下,脂质微团可以包装一些ECM分子,这些分子被运送到MVB并通过外泌体释放。此外,软ECM上的细胞中的肌动蛋白细胞骨架较稀疏,从而促进了MVB融合和外泌体释放。ECM还提供了促进EV释放的化学信号,包括氧气张力、pH值和激活细胞内钙水平的信号分子。
图2、细胞外囊泡(EV)在细胞外基质(ECM)中的生物发生机制。细胞外囊泡(EV)的生物发生与脂质-膜转运过程以及调节此过程的细胞外基质(ECM)中的物理化学因素密切相关。脂质微团作为多囊体体(MVBs)的前体,通过提供胆固醇和鞘脂等脂质来发挥作用。胆固醇介导内体分选复合物的招募,而鞘脂则诱导负曲率以形成内腔囊泡(ILVs)。在脂质微团的内吞作用期间,膜的丧失可以通过MVB融合期间膜的增加来抵消,从而平衡膜张力。当ECM较软时,脂质微团,包括洞窟小泡,更容易形成,因为它们不用来对抗机械应力。在这种情况下,脂质微团可以包装一些ECM分子,这些分子被运送到MVB并通过外泌体释放。此外,软ECM上的细胞中的肌动蛋白细胞骨架较稀疏,从而促进了MVB融合和外泌体释放。ECM还提供了促进EV释放的化学信号,包括氧气张力、pH值和激活细胞内钙水平的信号分子。
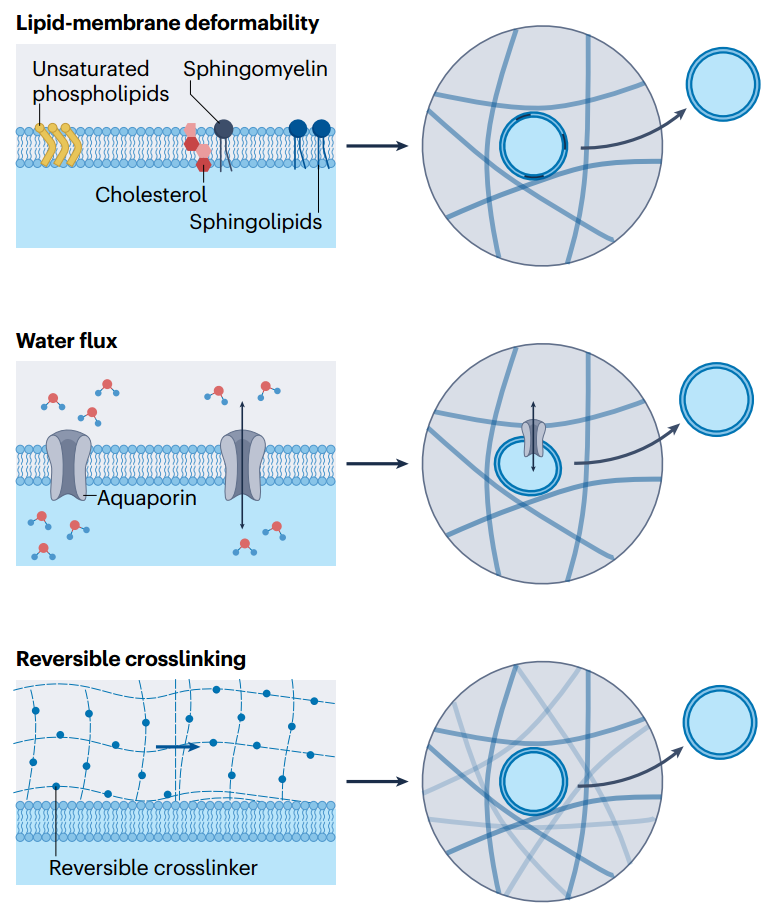 图4、EV在细胞外基质中运输的生物物理机制。在某些条件下,细胞外囊泡(EV)可以轻松地通过纳米多孔网络运输,而不依赖于聚合物降解或对流。EV含有一组独特的脂质,可以使EV变形。EV通过水通道蛋白流动水的能力使它们能够在网络中变形,从而帮助它们抵抗渗透压的变化。除了EV变形性之外,细胞外基质交联可能需要可逆,以便EV与交联结合并在运输过程中重新排列网络。
图4、EV在细胞外基质中运输的生物物理机制。在某些条件下,细胞外囊泡(EV)可以轻松地通过纳米多孔网络运输,而不依赖于聚合物降解或对流。EV含有一组独特的脂质,可以使EV变形。EV通过水通道蛋白流动水的能力使它们能够在网络中变形,从而帮助它们抵抗渗透压的变化。除了EV变形性之外,细胞外基质交联可能需要可逆,以便EV与交联结合并在运输过程中重新排列网络。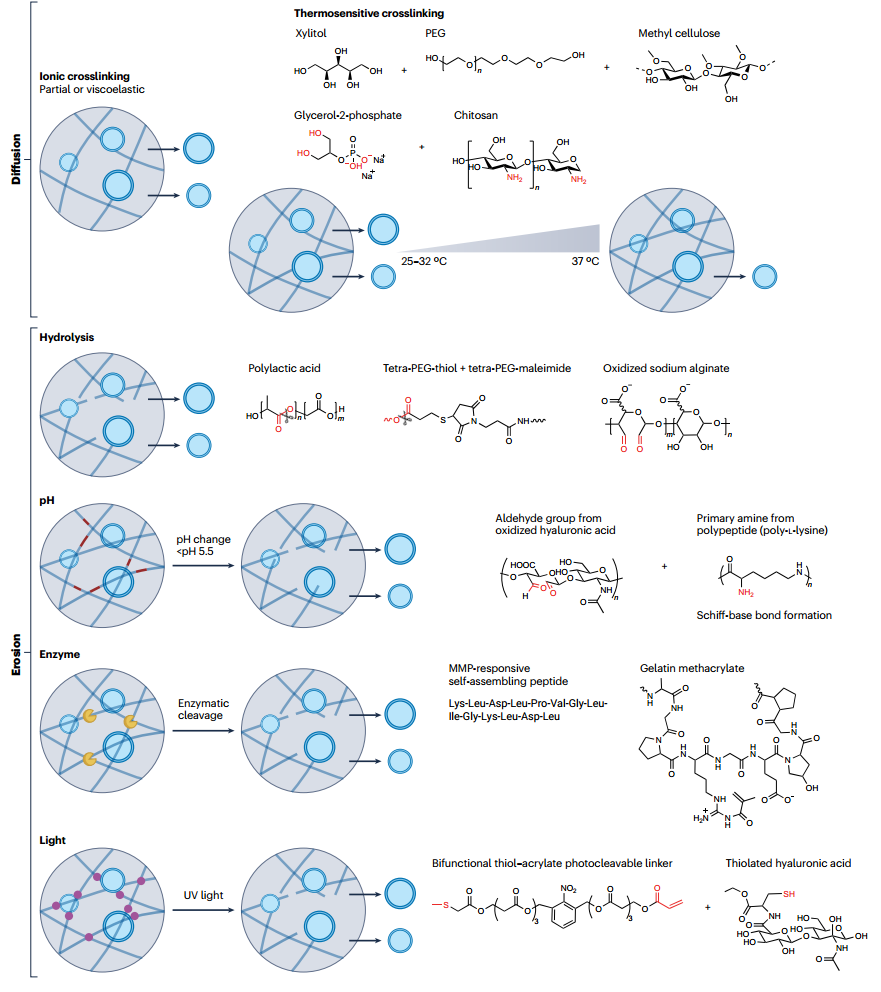 图5、控制EV释放的生物材料策略。细胞外囊泡(EV)的释放可以通过扩散或侵蚀机制来控制。EV可以从部分交联或粘弹性水凝胶中扩散出来。热敏交联可以用来调节水凝胶中EV的扩散,其作为温度函数。为了更完整地局部释放EV,可以通过水解降解或对外部刺激的条件性反应来实现水凝胶网络的侵蚀。导致EV通过水凝胶网络的侵蚀释放的外部刺激可以分为取决于宿主组织条件的刺激,例如pH和酶的存在,以及使之能够按需释放的刺激,例如光。每个类别都显示了具体的示例。MMP,基质金属蛋白酶;PEG,聚乙二醇。
图5、控制EV释放的生物材料策略。细胞外囊泡(EV)的释放可以通过扩散或侵蚀机制来控制。EV可以从部分交联或粘弹性水凝胶中扩散出来。热敏交联可以用来调节水凝胶中EV的扩散,其作为温度函数。为了更完整地局部释放EV,可以通过水解降解或对外部刺激的条件性反应来实现水凝胶网络的侵蚀。导致EV通过水凝胶网络的侵蚀释放的外部刺激可以分为取决于宿主组织条件的刺激,例如pH和酶的存在,以及使之能够按需释放的刺激,例如光。每个类别都显示了具体的示例。MMP,基质金属蛋白酶;PEG,聚乙二醇。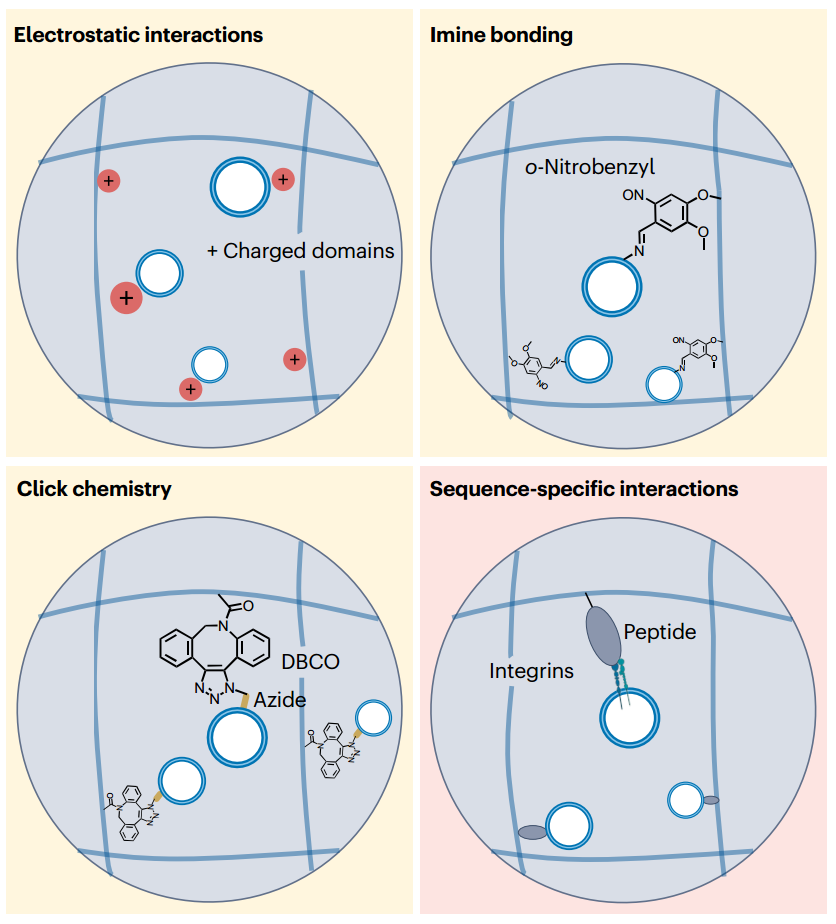 图6、促进外泌体保留的生物材料策略。在生物材料中引入外泌体(EVs)与聚合物网络之间的分子相互作用有助于保留EVs,以招募和在局部编程细胞。这些相互作用可以是一般性的,例如静电相互作用、亚胺键合和点击化学(例如,通过代苯环辛炔(DBCO)-偶氮共价键)来适应不同类型的EV亚群。相反,将分子序列引入聚合物网络,例如与整合素结合的粘附肽,可以捕获特定的EV亚群,从而引发特定的生物学反应。
图6、促进外泌体保留的生物材料策略。在生物材料中引入外泌体(EVs)与聚合物网络之间的分子相互作用有助于保留EVs,以招募和在局部编程细胞。这些相互作用可以是一般性的,例如静电相互作用、亚胺键合和点击化学(例如,通过代苯环辛炔(DBCO)-偶氮共价键)来适应不同类型的EV亚群。相反,将分子序列引入聚合物网络,例如与整合素结合的粘附肽,可以捕获特定的EV亚群,从而引发特定的生物学反应。