细胞外囊泡(EV)为基础的治疗方法的临床应用仍然具有挑战性,因为它们被迅速清除,驻留有限且产量低。虽然水凝胶具有阻碍生理清除和增加区域保留的能力,但它通常无法有效释放所结合的 EV,导致可及性和生物利用度降低。近日,上海交通大学医学院高小玲、复旦大学陈钧等团队合作在Adv Mater杂志上发表文章,报告了一种智能水凝胶,其中EV的释放由EV膜上的蛋白质调节。通过利用EV膜酶促进水凝胶降解,可以在给药部位实现持续保留和自刺激EV释放。为了实现这个目标,利用比较蛋白质组学鉴定了间充质干细胞衍生的细胞外囊泡(MSC-EVs)中具有基质降解活性的膜蛋白。随后,设计并合成了一种由自组装肽组成的水凝胶,这种水凝胶易于被MSC-EVs中存在的膜酶降解。鼻内给药后,这种肽水凝胶可以促进MSC-EVs的持续和热敏释放,从而延长MSC-EVs的保留时间,并显著增强其治疗阿尔茨海默病的潜力。
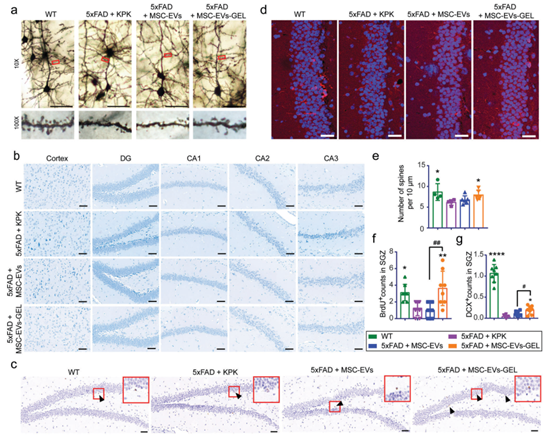
细胞外囊泡(EV)是一种细胞衍生的结构,携带生物活性分子,包括蛋白质、mRNA和miRNA。这些分子具有针对特定受体细胞并启动调节各种生物功能的信号通路的能力。此外,EV可以在细胞之间运输大分子。由于这些特性,EV为开发新疗法提供了独特的机会。值得注意的是,间充质干细胞衍生的EV(MSC-EVs)被认为是干细胞移植疗法的有希望的替代品。MSC-EVs具有刺激血管生成、抑制炎症、抵抗凋亡和促进再生的能力。这使得MSC-EVs成为神经退行性疾病管理的潜在候选者。作者研究团队最近完成了阿尔茨海默病(AD)患者的第一项临床试验(NCT04388982),其中人类脂肪 MSC-EVs 每周鼻内给药两次,持续12周,随后进行持续监测,以评估 MSC-EVs 用于 AD 治疗的安全性和有效性。令人鼓舞的是,在所有组的访问期间没有报告不良事件。此外,阿尔茨海默病评估量表(ADAS-cog)的得分在第12周与基线相比下降了2.33 ± 1.19,蒙特利尔认知评估基础分数增加了 2.38 ± 0.58,表明认知功能有所改善。值得注意的是,中剂量组的ADAS-cog得分一直下降,直到第36周下降了3.98分(相关报道:国际首个外泌体鼻喷临床试验治疗阿尔茨海默病)。这项临床试验强调了MSC-EVs在治疗中枢神经退行性疾病方面的潜力。然而,基于EV的疗法的临床转化仍面临着EV在给药部位的低保留和快速系统清除等挑战。同时,有限的生产产量和高昂的成本也阻碍了EV的可及性。因此,未来治疗应用的关键必须在于开发可控的、持续的输送系统,以延长EV在体内的保留时间并增强其生物利用度。水凝胶具有可调控的输送特性,通过调整材料组成、交联度和孔隙结构等参数,可以实现精确控制。这种可调性使得水凝胶能够实现多样化的释放动力学,从快速到缓慢的释放,直接影响治疗剂的功效和潜在副作用。为了提高EVs的临床转化潜力,已有研究设计了基于水凝胶的配方。这些配方包含亲水性聚合物,在水溶液中形成交联网络。然而,传统的水凝胶通常通过水凝胶的固有但逐渐的分解和药物的扩散来释放封装的药物。它们缺乏调节药物释放的能力,因此导致EVs的疗效降低。为了解决EVs输送所面临的挑战,迫切需要开发一种具有控制释放特性的水凝胶系统,特别是针对EVs输送而设计。细胞外囊泡(EV)被广泛认为是局部和远距离细胞间通讯的关键介质。为了实现有效的远距离细胞间通讯,EV必须表现出卓越的组织/细胞穿透能力,特别是在复杂的细胞外基质(ECM)中。渗透性在很大程度上由那些具有ECM降解活性的EV膜蛋白所促进。为了克服EV在水凝胶中的释放挑战并增强其功能,作者提出了一种智能水凝胶的开发,该水凝胶可以根据EV膜蛋白的酶活性释放EV。预计这种水凝胶可以延长EV在给药部位的保留时间并实现其受控释放。自刺激释放过程不仅可以增强稳定性,还可以延迟清除并实现更可靠的持续效应,从而提高EV的生物利用度。这些属性对于扩大应用场景和增强EV的临床转化潜力至关重要。为了验证上述假设,作者团队利用人类脂肪MSC-EVs作为模型,构建了一种对MSCEVs膜蛋白具有响应性的水凝胶。研究了水凝胶对MSC-EVs在治疗AD中的疗效的影响,这是最常见的神经退行性疾病和痴呆的主要原因。为了评估EVs膜蛋白作为酶促裂解水凝胶构建块的触发器的潜力,首先验证了MSC-EVs的ECM渗透性。与微胶质细胞系BV2来源的EVs相比,MSC-EVs的渗透性更高。随后进行了比较蛋白质组学分析,鉴定了MSC-EVs上的特定膜蛋白,这些膜蛋白表现出基质降解活性。基于MSC-EVs膜蛋白的酶活性,作者设计并合成了一种由自组装肽组成的水凝胶,这种水凝胶易于被MSC-EVs中存在的膜酶降解。鼻内给药后,这种智能释放水凝胶延长了MSC-EVs在给药部位的保留时间,以可控的方式释放了MSC-EVs,并显著增强了MSC-EVs用于AD治疗的疗效和临床转化潜力。这项研究提出了一种基于比较蛋白质组学的智能水凝胶设计方法,可以显著提高EV在临床环境中的适用性。MSC-EVs-GEL更有效地减轻5×FAD AD模型小鼠的神经元损伤并促进神经发生Huang M, Zheng M, Song Q, Ma X, Zhang Q, Chen H, Jiang G, Zhou S, Chen H, Wang G, Dai C, Li S, Li P, Wang H, Zhang A, Huang Y, Chen J, Gao X. Comparative Proteomics Inspired Self-Stimulated Release Hydrogel Reinforces the Therapeutic Effects of MSC-EVs on Alzheimer's Disease. Adv Mater. 2023 Dec 29:e2311420. doi: 10.1002/adma.202311420. PMID: 38157492.外泌体资讯网 【Adv Mater】上海交大高小玲等:自刺激释放水凝胶增强MSC-EVs对阿尔茨海默病的治疗效果