细胞外囊泡(EV)在细胞间通讯中发挥着至关重要的作用,参与旁分泌营养支持或有毒分子(包括蛋白质)的传播。RTP801是一种应激调节蛋白,其水平在神经退行性病变过程中升高并诱导神经元死亡。然而,RTP801毒性是否通过EV跨神经元转移仍不清楚。近日,JEV杂志上的一篇文章报道了RTP801通过细胞外囊泡介导培养物中的跨神经元毒性。
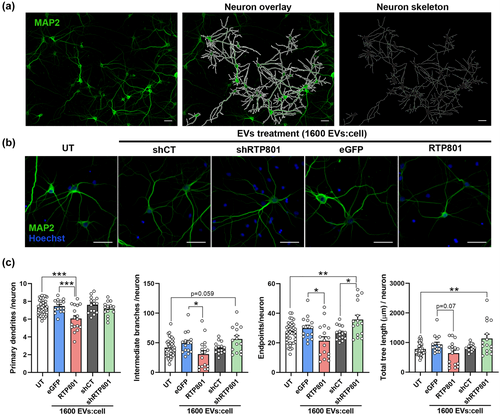
细胞间传递是多种神经退行性疾病的常见进展机制,包括帕金森病(PD)或阿尔茨海默病(AD)。越来越多的证据表明,蛋白质聚集物的类似朊病毒传播存在于相互连接的脑区域中,例如α-突触核蛋白或β-淀粉样蛋白。有研究表明,PD病理分期过程基于尸检脑中α-突触核蛋白聚集物的尾侧-头侧分布,并支持α-突触核蛋白可能向邻近细胞扩散的假设。因此,毒性蛋白的跨神经元传播可能有助于神经退行性疾病的早期阶段。然而,这种神经元间通信的精确机制以及对接受细胞产生的具体影响尚未完全阐明。EV在一般的细胞间通讯中充当载体,在中枢神经系统(CNS)中发挥着至关重要的作用。有不同类型的EV,根据大小、生物发生和组成等方面进行区分。其中,外泌体是50-100/150纳米的囊泡,在多囊泡体(MVBs)与质膜融合后,被输送到细胞外空间。相比之下,微囊泡是从质膜向外突出的0.1-1微米的囊泡。EV运输活性蛋白质、脂质、RNA和信号复合物,这些复合物在接收细胞中调节基因和蛋白质表达。EV是生物活性的,在神经元中,它们既可以是保护性的,也可以是有毒的。此外,EV在神经元发育和连接中起着至关重要的作用。在哺乳动物的神经系统中,皮层神经元通过依赖突触谷氨酸能活性和后突钙上升的过程分泌EV。最近,EV被提议作为转移毒性蛋白质的载体,例如与神经退行性疾病相关的α-突触核蛋白或β淀粉样蛋白。RTP801,也称为REDD1,是神经元的有毒蛋白质。RTP801足以诱导NGF分化的PC12细胞和培养的交感神经元和皮层神经元死亡。RTP801由应激反应基因DDIT4编码,其表达受缺氧、营养剥夺、地塞米松、硫酸钠、吐嘻甘露醇、热休克或肺细胞中的香烟烟雾诱导。在中枢神经系统中,RTP801的表达增加是对缺血、β-淀粉样肽、突变的亨廷顿蛋白(mhtt)以及PD模拟毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)和6-OHDA的反应。重要的是,RTP801不仅在细胞和动物病理模型中积累,而且在患有神经退行性疾病的患者样本中也有积累。实际上,RTP801蛋白在零星和突变的帕金氏病患者的多巴胺能神经元、亨廷顿病(HD)患者的尸检纹状体和神经元衍生的iPS细胞以及AD患者的淋巴细胞和尸检海马中升高。值得注意的是,DDIT4是PD和HD中三个常见上调转录本之一。一些研究表明,在神经退行性疾病的背景下,RTP801调节体外细胞毒性。与此一致,降低AD和HD小鼠模型中的RTP801可以预防认知缺陷和神经炎症。RTP801的作用机制涉及到靶向雷帕霉素(mTOR)和Akt生存激酶的顺序调节。mTOR存在两个复合物,每个复合物对底物具有不同的特异性。mTORC1复合物通过磷酸化底物如核糖体蛋白S6激酶/S6(RPS6)和4EBP1来调节蛋白翻译,而mTORC2复合物通过磷酸化Akt的丝氨酸残基473等底物来调节生存信号。在帕金森病中,RTP801作用于结节硬化1和2(TSC1/TSC2)的上游,从而抑制mTOR。因此,RPS6/4EBP1不能被mTORC1磷酸化,蛋白翻译被调节下降。但最重要的是,神经元存活激酶Akt不能被mTORC2磷酸化,因此无法增强促生存信号,从而引发神经元死亡。因此,鉴于RTP801蛋白在许多神经退行性疾病中上调并具有促凋亡作用,可能会导致神经元死亡,该研究旨在调查RTP801诱导的培养毒性是否可以通过EVs转移至其他神经元,作为神经退行性疾病传播的潜在机制。研究结果表明,RTP801存在于神经元来源的EVs中,并促进它们装载促凋亡蛋白,这可能有助于将毒性转移至神经元。跨神经元RTP801会损害神经元树突分枝并激活受体神经元的凋亡。此外,神经元来源的EVs对神经元产生营养作用,激活mTOR/Akt信号通路,当EVs来源于6-OHDA应激神经元时,该效应会丧失通过RTP801。使用源自RTP801过表达神经元的EV进行处理可减少神经元树枝化,而源自 shRTP801 的EV会增加神经元形态的复杂性该研究在培养的皮质神经元中过度表达或沉默RTP801蛋白,分离其衍生的EV(分别为RTP801-EV或shRTP801-EV),并通过质谱(MS)表征EV蛋白含量。通过用这些EV处理培养的神经元并量化凋亡神经元死亡和分支来评估RTP801-EV的毒性。该研究还在6-羟基多巴胺(6-OHDA)的病理体外模型中测试了shRTP801-EV的功能。RTP801的表达增加了神经元释放的EV数量。此外,RTP801导致神经元来源的EV具有独特的蛋白质组特征,包含更多促凋亡标记。因此,该研究观察到RTP801诱导的毒性通过EV转移到神经元,激活细胞凋亡并损害神经元形态复杂性。相比之下,shRTP801-EV能够增加受体神经元的树枝化。6-OHDA神经毒素升高了EV中RTP801的水平,并且6-OHDA衍生的EV通过Akt和RPS6下游效应器失去了mTOR/Akt信号传导激活。有趣的是,来自神经元的EV在暴露于6-OHDA之前被沉默的RTP801保持了受体神经元中的Akt和RPS6反式激活。总而言之,这些结果表明RTP801诱导的毒性是通过EV转移的,因此,它可能有助于RTP801参与的神经退行性疾病的进展。Solana-Balaguer J, Martín-Flores N, Garcia-Segura P, Campoy-Campos G, Pérez-Sisqués L, Chicote-González A, Fernández-Irigoyen J, Santamaría E, Pérez-Navarro E, Alberch J, Malagelada C. RTP801 mediates transneuronal toxicity in culture via extracellular vesicles. J Extracell Vesicles. 2023 Nov;12(11):e12378. doi: 10.1002/jev2.12378. PMID: 37932242; PMCID: PMC10627824.外泌体资讯网 JEV:RTP801通过细胞外囊泡介导毒性跨神经元传递