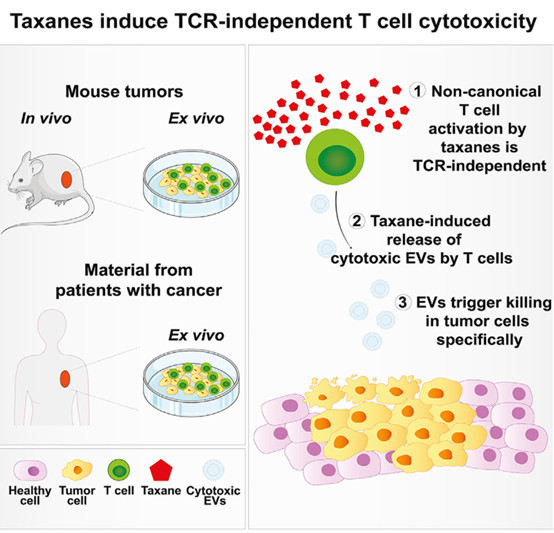
尽管用紫杉烷类药物治疗并不总能带来临床益处,但所有患者都有发生周围神经病变等有害副作用的风险。了解紫杉烷类的体内作用模式有助于设计改进的治疗方案。近日,Cancer Cell杂志上发表一篇文章, 报道了紫杉烷类直接刺激T细胞释放细胞毒性细胞外囊泡以根除肿瘤细胞的作用模式。紫杉烷类预处理的T细胞可以增强抗肿瘤作用,同时避免全身毒性。
紫杉烷是治疗癌症最广泛使用的化学疗法之一,但也有有害的毒副作用,其中一些是不可逆的,例如周围神经病变、发热性中性粒细胞减少症、癫痫发作和脑病。尽管接受紫杉烷类药物治疗的所有患者都会出现这些不良副作用,但并非所有患者都能获得临床益处。 例如,对 100,000 名乳腺癌患者的长期结果进行的荟萃分析显示,在蒽环类药物治疗方案中加入紫杉烷类药物仅能延长约 3% 的患者的生存期。为了最大限度地发挥紫杉烷类药物的抗肿瘤作用,同时限制它们的毒性,了解紫杉烷类的体内作用方式至关重要,但这仍然存在争议。四十多年来,紫杉烷类药物(如多西紫杉醇和紫杉醇)的抗癌活性主要归因于它们通过稳定微管触发异常有丝分裂纺锤体形成的能力,导致有丝分裂进程延迟并最终导致细胞死亡,这主要是基于体外实验得出的结论。相反,来自动物模型和癌症患者的数据表明,紫杉烷类可能会诱导细胞凋亡,而与阻断有丝分裂进程无关。例如,之前曾报道紫杉烷类通过扰乱体外癌细胞有丝分裂进程引发细胞凋亡,而紫杉烷介导的对在体内环境中生长的相同癌细胞的杀伤与此类有丝分裂缺陷无关。同样,对人类和小鼠肿瘤组织的分析表明,用紫杉烷治疗仅诱导中度有丝分裂指数增加,这与肿瘤对治疗的反应无关。总之,这些研究表明紫杉烷类的另一种、无关有丝分裂的作用机制必然在体内活跃;然而,此类机制尚未被发现。体外和体内实验环境之间的一个主要区别是微环境中存在免疫细胞,即使在维持某些免疫功能和未成熟免疫细胞的免疫功能低下的癌症模型中也是如此。这可能与紫杉烷治疗特别相关,因为化疗可以影响癌症背景下的免疫反应。因此,除了杀死癌细胞外,化疗还可以影响免疫反应,例如 ,诱导免疫原性细胞死亡 (ICD) 和染色体不稳定或修改癌细胞的表位呈递。考虑到肿瘤微环境 (TME) 在患者中可能具有高度异质性,TME 在驱动抗肿瘤中的作用 紫杉烷类药物的作用可能解释了临床上对紫杉烷类药物的部分反应。少数研究报告了紫杉烷类药物对肿瘤免疫微环境的调节作用。例如,具有高肿瘤淋巴细胞浸润的乳腺癌患者对含紫杉烷类药物的化疗有更好的临床反应。尽管这些研究指出免疫微环境在驱动紫杉烷的体内抗肿瘤作用中的潜在作用,但紫杉烷诱导细胞死亡的这种作用的分子机制仍然未知。该研究旨在表征紫杉烷介导的杀伤作用在体内环境中的作用模式。使用小鼠和患者来源的癌症模型、自体类器官和 T 细胞共培养平台以及蛋白质组学分析,研究发现紫杉烷类可以直接激活 T 细胞以特异性根除肿瘤细胞。从机制上讲,研究证明紫杉烷类诱导T细胞释放细胞毒性细胞外囊泡,随后引发肿瘤死亡。还揭示了用紫杉烷类离体预处理的 T 细胞一旦移植到体内就具有抗肿瘤能力。这些发现确立了紫杉烷类在体内的作用模式,紫杉烷类是最广泛使用的癌症治疗化学疗法之一。至关重要的是,该研究提供了一种治疗方法来利用紫杉烷类的最佳T细胞依赖性抗肿瘤活性,同时避免全身暴露于它们的毒性。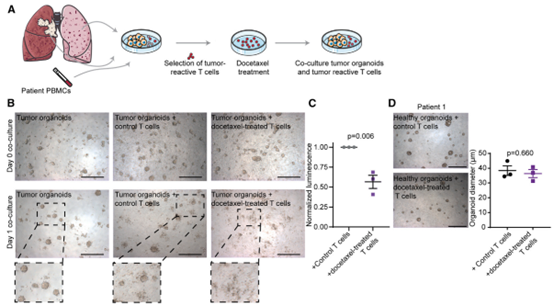
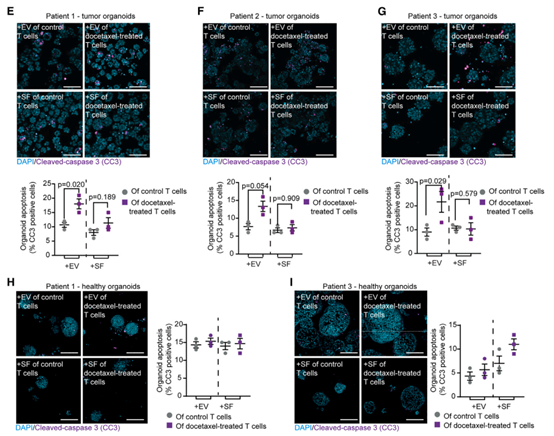
来自癌症患者的类器官中,多西紫杉醇通过释放EV增加T细胞的细胞毒性总之,该报道发现,在体内,紫杉烷类直接触发T细胞以非规范的、T 细胞受体非依赖性方式选择性地杀死癌细胞。从机制上讲,紫杉烷类诱导T细胞释放细胞毒性细胞外囊泡,从而导致肿瘤细胞特异性凋亡,同时保持健康的上皮细胞完好无损。利用这些发现开发了一种有效的治疗方法,该方法基于体外紫杉烷预处理T细胞的转移,从而避免了全身治疗的毒性。该研究揭示了一种最常用的化学疗法的不同体内作用模式,并开辟了利用紫杉烷类T细胞依赖性抗肿瘤作用同时避免全身毒性的途径。该研究发现的关键点:
- 紫杉烷增加TCR非依赖性和TCR介导的T细胞杀伤;
对此研究报道,复旦大学邵志敏教授研究团队发表了preview。邵志敏教授总结道,这项研究有几个优势,包括显著的概念进步和一套全面的体外和体内实验模型。这些模型的利用有助于彻底阐明紫杉烷类的新功能机制,为探索化疗与肿瘤免疫之间的相互作用奠定了宝贵的基础。然而,同样值得注意的是,本研究中调查的机制可能有一些局限性。作者没有探索在紫杉烷预处理的T细胞中刺激细胞毒性EV分泌的因素。此外,这项研究没有揭示细胞毒性EV根除肿瘤细胞的机制,也没有阐明为什么它们不影响健康细胞。尽管如此,这项研究的重要发现强调需要在即将进行的调查中彻底探索化疗药物对完整肿瘤生态系统的影响。在此探索过程中,还应考虑免疫细胞亚群的功能状态及其相互作用。最终,必须努力优化化疗方案,以提高疗效,同时减轻不良副作用。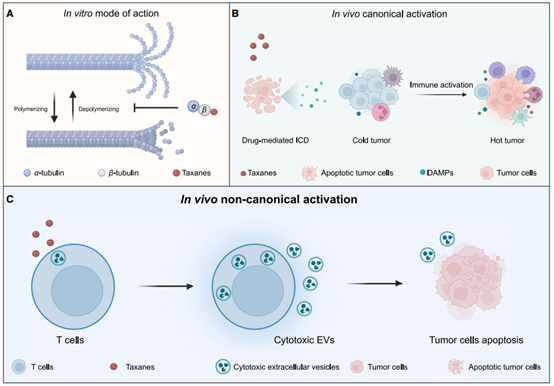
紫杉烷的体外和体内作用模式。(A) 紫杉烷稳定微管中的微管蛋白,从而在体外抑制细胞分裂过程和癌症进展。 (B) 紫杉烷类通过释放DAMP和激活抗肿瘤免疫,有效诱导肿瘤细胞的免疫原性细胞死亡。 (C) 一种全新的紫杉烷体内作用模式,这些药物可以直接刺激T细胞释放细胞毒性 EV,并在不依赖TCR激活的情况下消除肿瘤细胞。总而言之,这项研究代表了我们对化疗甚至免疫肿瘤学理解的范式转变。这一前沿发现本身将潜在地促进紫杉烷类药物临床给药的优化。Vennin C, Cattaneo CM, Bosch L, Vegna S, Ma X, Damstra HGJ, Martinovic M, Tsouri E, Ilic M, Azarang L, van Weering JRT, Pulver E, Zeeman AL, Schelfhorst T, Lohuis JO, Rios AC, Dekkers JF, Akkari L, Menezes R, Medema R, Baglio SR, Akhmanova A, Linn SC, Lemeer S, Pegtel DM, Voest EE, van Rheenen J. Taxanes trigger cancer cell killing in vivo by inducing non-canonical T cell cytotoxicity. Cancer Cell. 2023 Jun 12;41(6):1170-1185.e12. doi: 10.1016/j.ccell.2023.05.009. PMID: 37311414.Xu Y, Xiao Y, Shao ZM. Taxanes directly induce T cell cytotoxic extracellular vesicles to eradicate tumor cells. Cancer Cell. 2023 Jun 12;41(6):1011-1013. doi: 10.1016/j.ccell.2023.05.012. PMID: 37311412.外泌体资讯网 Cancer Cell:紫杉烷诱导T细胞释放细胞毒性EVs触发体内癌细胞杀伤