Evelo Biosciences公司是一家临床阶段生物技术公司,开发作用于小肠轴SINTAX的新型口服抗炎药物平台,近日宣布其首个细胞外囊泡(EV)候选产品EDP2939,在完成第一批人类志愿者的安全性和耐受性审查后,已在2期牛皮癣(银屑病)临床试验中进行给药。多个递增剂量队列的安全性和耐受性评估仍在继续。
“这是EDP2939和Evelo更广泛的口服EV平台的里程碑,”Evelo首席医疗官Duncan McHale博士说。“这是第一次将潜在的细菌EV药物口服给人类。安全性和耐受性是Evelo开发药物以治疗所有阶段和所有类型炎症性疾病的愿景的核心部分。我们现在已经开始在中度银屑病患者的2期试验中给药。”
Evelo研发总裁兼首席科学官Mark Bodmer博士补充说,“EV和EDP2939作为一种新型SINTAX药物显示出巨大的前景,具有基于三个因素的生物样疗效潜力:(1) EV在临床前模型中的高内在效力;(2)单个胶囊中可递送的EV的数量和浓度;(3)递送至近端小肠的靶位点。我们期待在今年下半年报告EDP2939银屑病疗效结果。”
关于EDP2939临床试验
EDP2939-101是一项多中心随机、安慰剂对照的1/2期试验,评估EDP2939的安全性、耐受性和临床疗效。该试验的A部分(第1阶段)旨在确定人类志愿者在多次递增剂量下的安全性和耐受性。A部分的主要终点是安全终点:AE、SAE、生命体征、安全实验室测试和ECG。
B部分(第2阶段)旨在确定EDP2939在建议治疗剂量下对中度斑块状银屑病患者的疗效。主要终点是在每天口服EDP2939或安慰剂16周后,银屑病面积和严重程度指数(PASI)评分(PASI-50反应)比基线改善50%的患者比例。次要终点包括医生和患者报告的几项银屑病结果,以及进一步的安全性评估。该试验将包括大约110名患者,他们以1:1的比例随机分配接受EDP2939胶囊或匹配的安慰剂。
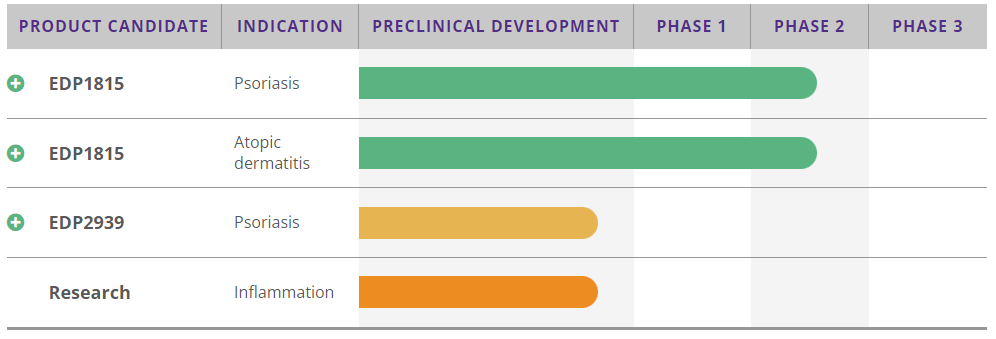
Evelo公司pipeline
关于Evelo Biosciences
Evelo Biosciences是一家临床阶段的生物技术公司,开发一种作用于小肠轴的口服抗炎药物SINTAX的新型平台,具有全身治疗效果。小肠在控制全身炎症方面起着核心作用。该公司的候选产品是单株微生物或其细胞外囊泡(EV)的药物制剂。Evelo最初在开发治疗牛皮癣和特应性皮炎的EDP1815,以及治疗牛皮癣的EDP2939。Evelo的愿景是创造有效、安全、耐受性良好且负担得起的疗法,以改善数十亿炎症性疾病患者的生活。如果证明对Th1、Th2或Th17炎症通路介导的炎症性疾病有效,那么这些相同的研究药物可能对其他炎症性疾病有效,例如银屑病和其他形式的关节炎、哮喘、过敏和炎症性肠病。
EDP2939前期数据
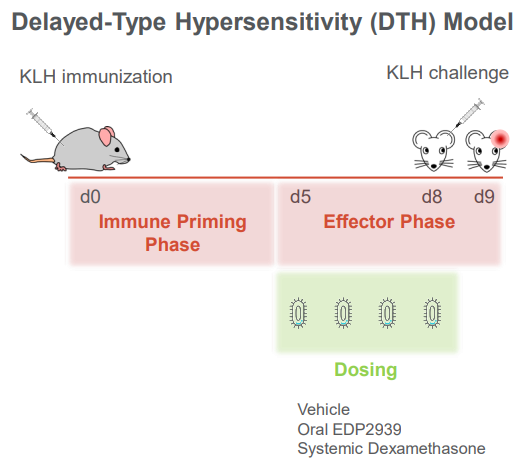
小鼠KLH-DTH模型作为炎症的临床前模型
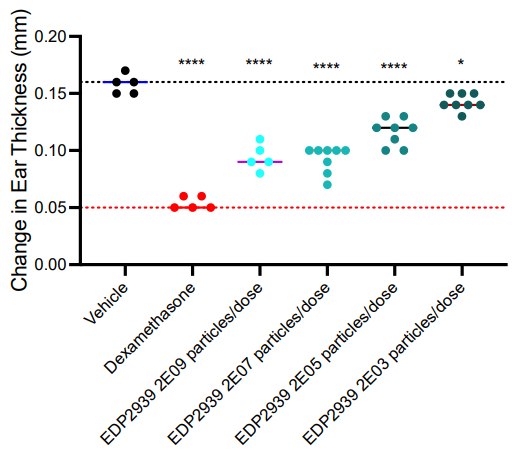
临床前数据表明EV是有效的疗法
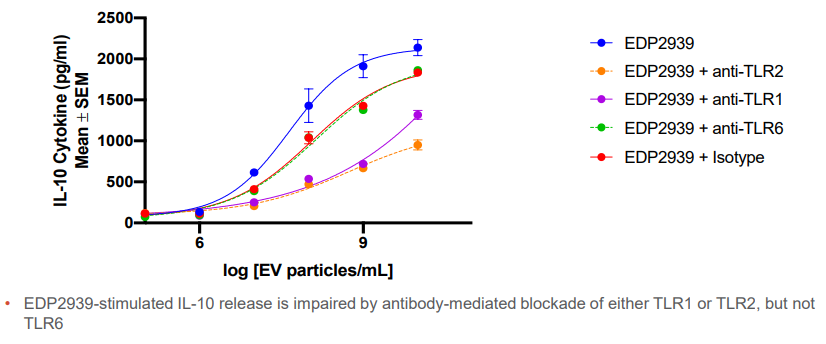
EDP2939通过TLR刺激诱导IL-10的释放
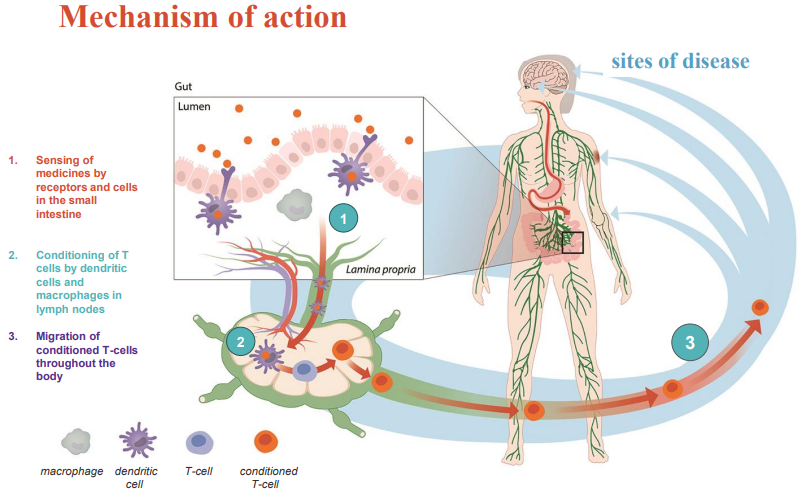
作用机制
参考资料:Evelo