信使RNA疗法的成功在很大程度上取决于能够安全、有效和稳定地将遗传物质转化为功能性蛋白质的递送系统的可用性。近日,来自北京大学深圳研究生院的Andrew S Lee 教授团队在Nature Biomedical Engineering杂志上发表文章,报道展示了通过人真皮成纤维细胞的细胞纳米穿孔产生的细胞外囊泡(EV),封装编码细胞外基质α1I型胶原蛋白(COL1A1)的mRNA诱导胶原蛋白移植物的形成并减少具有光老化皮肤小鼠的皱纹形成。研究还表明,通过微针阵列皮内递送载有mRNA的EV可导致动物真皮中胶原蛋白的合成和替换时间延长且更均匀。基于EV的COL1A1 mRNA的皮内递送可能成为治疗光老化皮肤的有效蛋白质替代疗法。
信使RNA修饰技术的最新发展提高了mRNA递送的治疗效率及其近期临床应用的潜力,包括蛋白质替代疗法和针对严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2)病毒的疫苗接种。然而,mRNA固有的不稳定性和潜在的免疫原性要求将它们封装在运载工具中。当前的mRNA递送方式集中于使用脂质纳米颗粒(LNP)载体进行封装和递送。然而,LNPs带来了几个主要挑战,包括细胞毒性、生物分布差、缺乏靶标特异性和免疫原性。这些问题可能是由于LNP需要表面PEG化(PEG代表聚(乙二醇))以改善其循环半衰期和减少非特异性清除。值得注意的是,在人体中使用LNP与过敏反应、超敏反应和自身免疫不良事件有关。因此,鉴定能够克服这些LNP相关挑战的mRNA载体将有助于进一步开发基于mRNA的疗法。
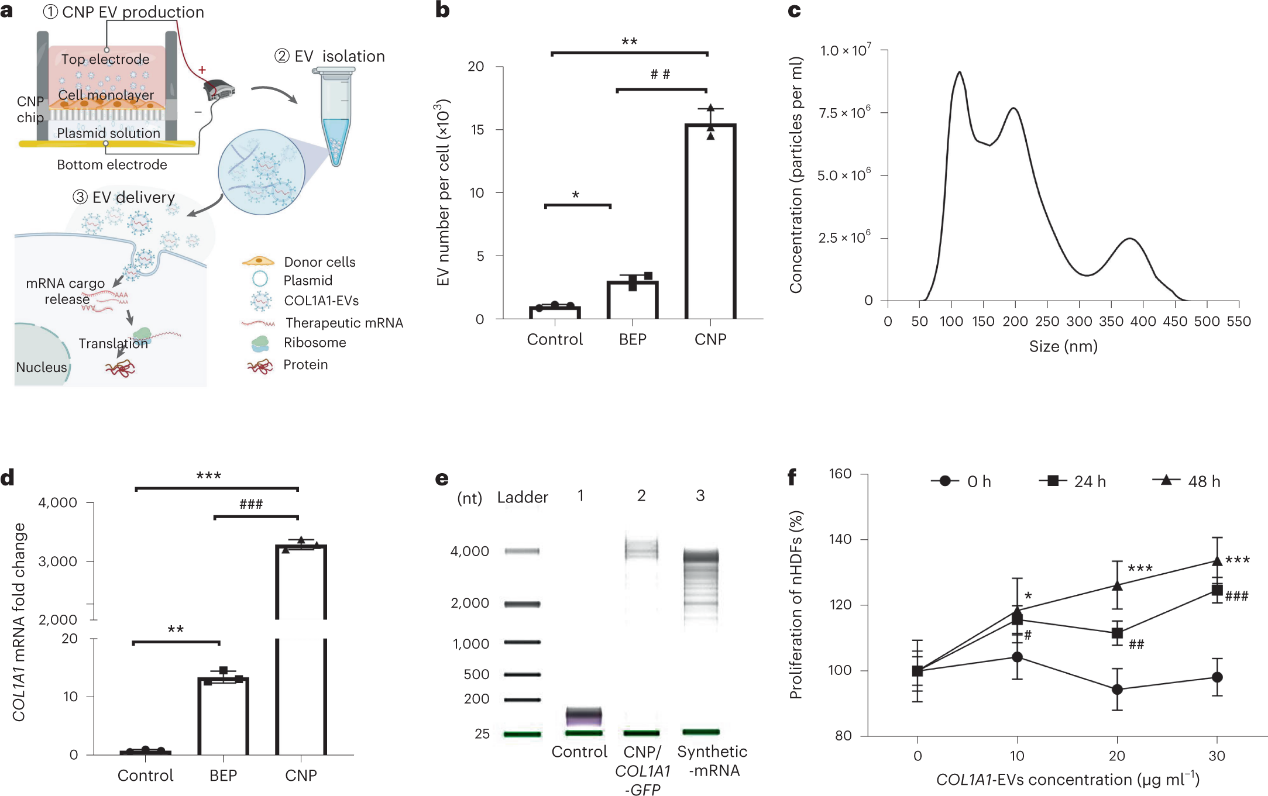
细胞外囊泡(EV),包括外泌体和微泡,在人体内运输生物分子和核酸(包括mRNA)方面发挥着重要作用。因此,近年来,EV因其内在的生物相容性、跨越生理障碍的能力和低免疫原性,已成为基于核酸的治疗的有前途的载体。与LNP不同,包括外泌体在内的EV是由人体细胞内源性产生的,可导致较低水平的炎症反应。此外,已经开发出廉价且容易地生产大量外泌体的策略。作者之前报道了一种细胞纳米孔(CNP)方法,其中在源细胞表面创建瞬态纳米孔,以允许将全转录mRNA大规模加载到分泌的EVs中(https://www.exosomemed.com/6581.html )。
CNP产生大量载有COL1A1 mRNA的EV
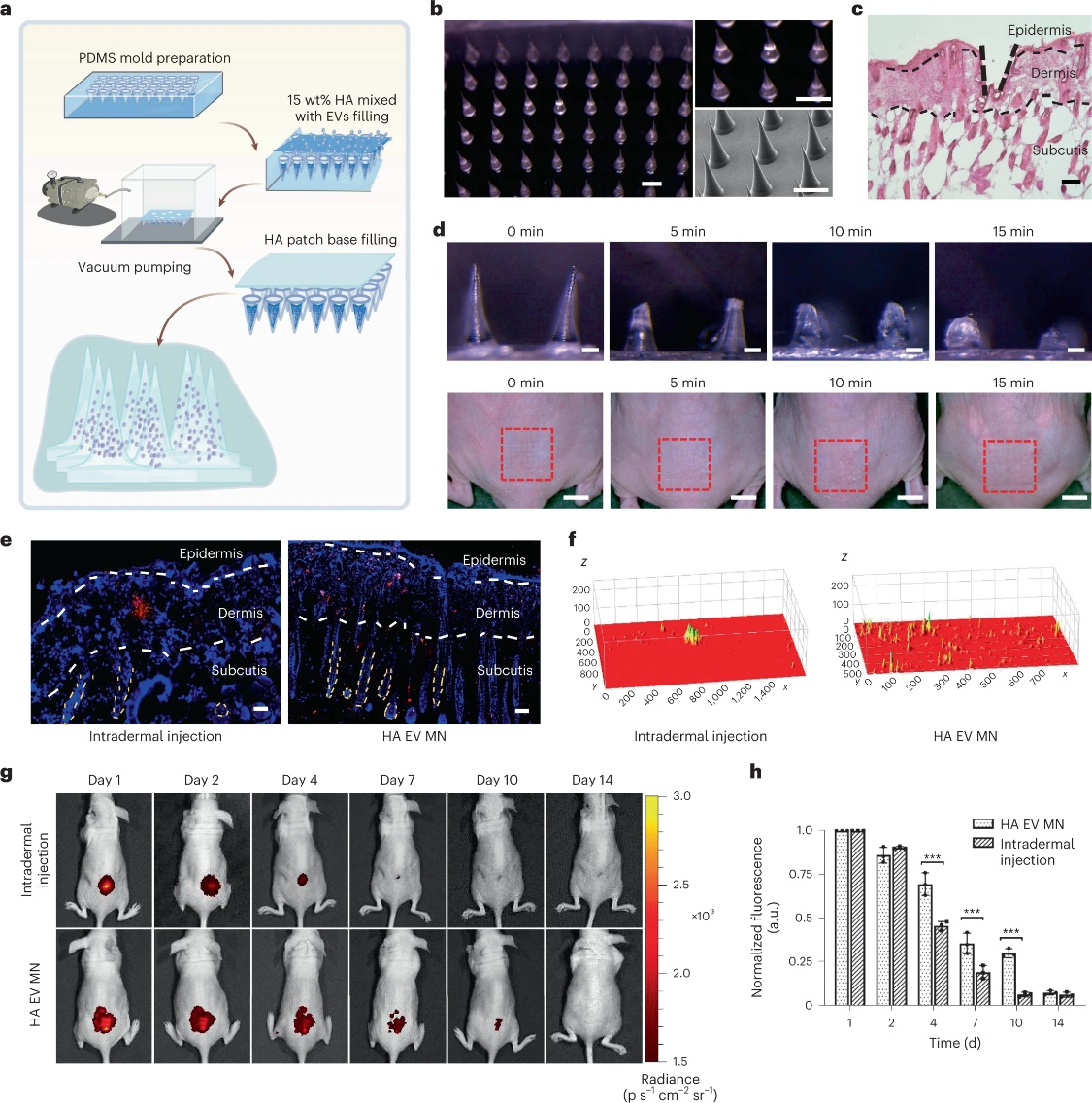
该研究通过使用与人类老化受损皮肤的病理生理学特征非常相似的急性光老化小鼠模型,报道展示了基于外泌体的COL1A1 mRNA疗法替代真皮胶原蛋白损失作为光老化抗衰老疗法的效用皮肤。为了提高mRNA递送和保留的效率,研究还表明,通过透明质酸(HA)微针(COL1A1-EVMN)贴片递送胶原蛋白mRNA可以更有效地在真皮中分布mRNA,从而产生持久的胶原蛋白-蛋白质植入和改善光老化皮肤皱纹的治疗。
用于改善组织中EV分布的微针输送系统
参考文献:
You Y, Tian Y, Yang Z, Shi J, Kwak KJ, Tong Y, Estania AP, Cao J, Hsu WH, Liu Y, Chiang CL, Schrank BR, Huntoon K, Lee D, Li Z, Zhao Y, Zhang H, Gallup TD, Ha J, Dong S, Li X, Wang Y, Lu WJ, Bahrani E, Lee LJ, Teng L, Jiang W, Lan F, Kim BYS, Lee AS. Intradermally delivered mRNA-encapsulating extracellular vesicles for collagen-replacement therapy. Nat Biomed Eng. 2023 Jan 12. doi: 10.1038/s41551-022-00989-w. PMID: 36635419.