CRISPR/Cas9基因组编辑是治疗多种遗传疾病的非常有前景的途径。然而,封装CRISPR/Cas9进行递送仍然非常具有挑战性。蛋白质N-豆蔻酰化是一种不可逆的翻译时/后修饰,导致豆蔻酰基共价连接到靶蛋白的N末端。它充当蛋白质与细胞膜结合的锚,并决定其细胞内运输和活性。细胞外囊泡(EV)是分泌的囊泡,可介导细胞间通讯。近日,来自乔治亚大学的蔡后建教授在JEV杂志发表文章,证明了豆蔻酰化蛋白优先封装在EV中。
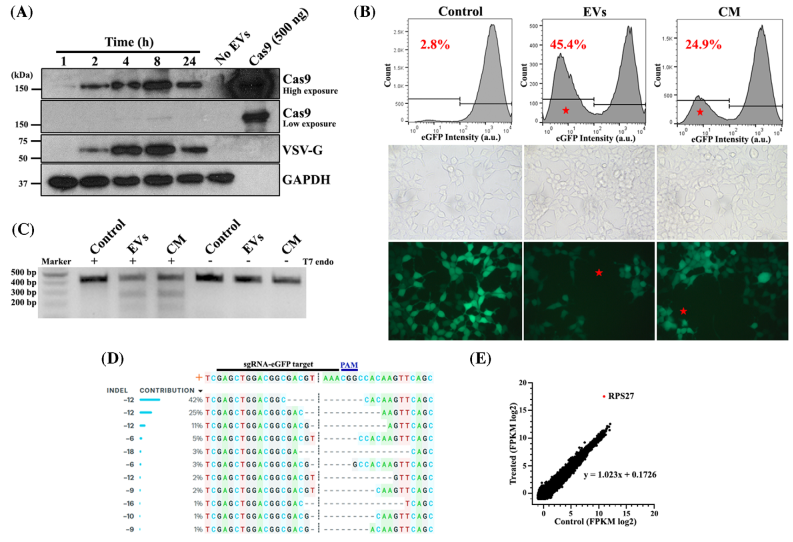
源自Src激酶N末端前导序列的八肽是N-豆蔻酰转移酶1(一种催化肉豆蔻酰化的酶)的有利底物。八肽融合到Cas9的N末端促进了Cas9的豆蔻酰化和封装到EV中。使用蛋白酶消化测定证实了Cas9和sgRNA-eGFP在EV内的封装。此外,为了提高转染潜力,将VSV-G引入EV。EV中封装的Cas9占EV总蛋白的0.7%。重要的是,涂有VSV-G的封装Cas9/sgRNA-eGFP的EV显示出高达42%的eGFP敲除效率,并且在受体细胞中的脱靶效应有限。该研究提供了一种将CRISPR/Cas9蛋白和sgRNA封装到EV中的新方法。这种策略可能会开辟一条有效途径,利用EV作为载体,为基于基因组编辑的基因治疗递送CRISPR/Cas9。
CRISPR/Cas9系统是一种很有前途的基因治疗技术。当前的递送方法包括物理方法、病毒载体(慢病毒或腺相关病毒)或非病毒载体(脂质、纳米颗粒等)。然而,由于CRISPR/Cas9尺寸大(约160kDa)以及Cas9和sgRNA的表面电荷、封装处理的复杂性、潜在的宿主免疫反应以及使用当前递送方法时Cas9/sgRNA核糖核蛋白(RNP)复合物在循环中的不稳定性,因此挑战仍然存在。
细胞外囊泡(EV)几乎由所有细胞类型分泌,由两种主要类型的囊泡组成,即外泌体(exosomes)和ectosomes等。ectosomes是由质膜出芽产生的,直径约为50nm至1μm,而外泌体的直径约为40-160nm,是通过多泡体(MVB)与质膜融合的胞吐作用产生的。EV包含脂质、mRNA、microRNA和蛋白质,例如整合素和受体酪氨酸激酶。它们已被用作诸如紫杉醇和阿霉素、siRNA、化学修饰的mRNA和过氧化氢酶等蛋白质的化合物的递送载体。EVs可以通过扩散转移到邻近细胞或通过体循环转移到远处,在与局部微环境或远端组织的细胞间通讯中发挥重要作用。例如,将EV中的包装内容物传递给受体细胞会促进恶性转化和肿瘤进展,为转移细胞建立转移前生态位,并介导免疫逃逸,从而传播各种疾病。将有效内容物封装到EV中涉及通过物理方法(如超声和电穿孔)、化学方法(如lipofectamine)或生物过程介导的预加载或后加载。例如,脂质纳米颗粒可以通过内吞作用封装到EV中,以传递治疗性mRNA。嵌合蛋白的基因工程已被应用于通过利用外泌体膜蛋白将感兴趣的蛋白质封装到EV中。
已经开发了许多基于EV的封装方法,用于在体内递送Cas9/sgRNA RNP复合物。例如,“Gesicles”和NanoMEDIC利用FKBP/FRB二聚化系统封装Cas9/sgRNARNP。另一种封装策略依赖于CD63运输和GFP-GFP纳米体的相互作用。“VEsiCas”依靠Gag或最小Gag蛋白与Cas9的融合,将Cas9/sgRNA RNP封装到EV中进行递送。其中一些技术处理起来非常复杂,或者需要对Cas9进行大量修改。
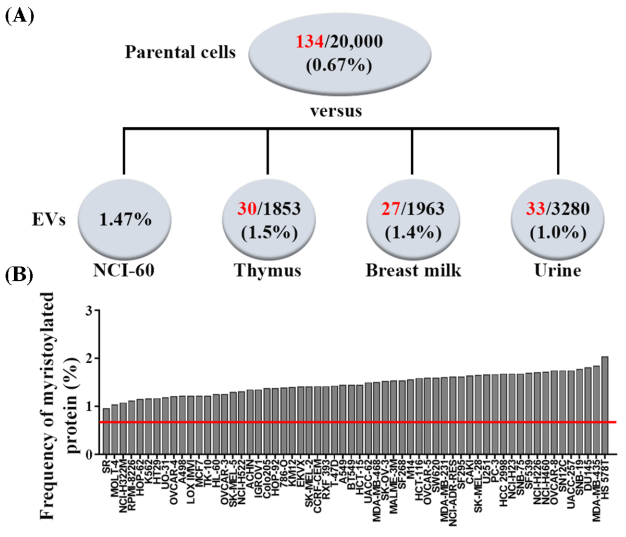
胞外囊泡 (EVs) 中豆蔻酰化蛋白的出现频率升高
蛋白质N-豆蔻酰化是一种翻译时/后修饰,导致肉豆蔻酰基(14个碳饱和脂肪酰基)共价连接到靶蛋白的N末端。在豆蔻酰化蛋白中报道了N末端Met-Gly2-x-x-x-Ser/Thr6的共有序列。在蛋白质翻译过程中第一个蛋氨酸被蛋氨酸氨基肽酶去除后,N末端的甘氨酸残基需要用作肉豆蔻酰基的附着位点。豆蔻酰化对于豆蔻酰化蛋白的活性及其与细胞膜的结合是必不可少的。一个例子是Src家族激酶(SFK),它是一组非受体酪氨酸激酶,是众多信号转导途径中的关键调节剂。SFK由一个N端Src同源性(SH)4区域控制膜结合组成。SH4结构域通过豆蔻酰化介导膜结合,并且取决于SFK,棕榈酰化。SFK的豆蔻酰化和/或棕榈酰化的差异模式决定了它们的细胞定位、细胞内运输以及随后的激酶活性和转化潜力。
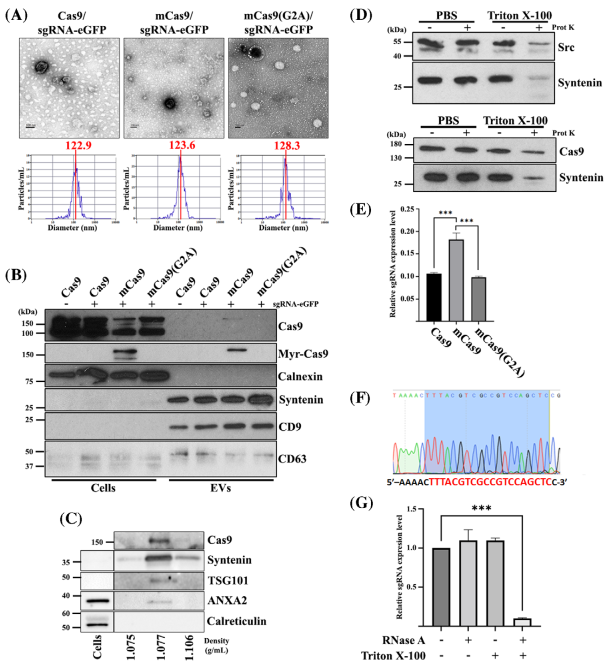
N-豆蔻酰化促进了Cas9/sgRNA-eGFP封装到EV中
由于豆蔻酰化蛋白与质膜的关联,该研究探讨了蛋白豆蔻酰化是否可用于将Cas9封装到EV中。研究证明了豆蔻酰化蛋白优先富集在EV中。源自Src激酶的八肽与Cas9蛋白N端的融合促进了其封装到EV中。涂有VSV-G并封装修饰的Cas9/sgRNA-eGFP的EV以高达42%的效率敲除HEK293T-eGFP细胞中的eGFP基因。这种方法代表了一种将CRISPR复合物封装到EV中的简单有效的方法,并且可能在基于EV的基因组编辑治疗中得到应用。
涂有VSV-G并封装mCas9/sgRNA-eGFP的EV敲除HEK293T-eGFP细胞中的eGFP基因
这项研究仅限于针对eGFP基因。未来的研究将集中该技术在靶向内源性功能基因和监测下游信号传导和生物学结果方面的应用。尽管如此,该研究首次证明了蛋白豆蔻酰化可用于将目标蛋白(如Cas9)封装到EV中。这可能为基于EV的体内基因治疗提供了一条途径。
参考文献:
WhitleyJA, Kim S, Lou L, Ye C, Alsaidan OA, Sulejmani E, Cai J, Desrochers EG, BeharryZ, Rickman CB, Klingeborn M, Liu Y, Xie ZR, Cai H. Encapsulating Cas9 intoextracellular vesicles by protein myristoylation. J Extracell Vesicles. 2022Apr;11(4):e12196. doi: 10.1002/jev2.12196. PMID: 35384352.