肿瘤转移微环境中的肿瘤的分泌物与基质之间的交流对促进癌症转移具有关键作用。然而,该机制还不是很清楚。1月15日,来自第二军医大学东方肝胆外科研究所的王红阳院士和杨文副研究员课题组在Nature Conmmunications杂志发表论文,通过microarray检测高转移癌细胞和低转移癌细胞的外泌体,发现肿瘤来源的关键外泌体miRNA能在转移前微环境中将成纤维细胞转化成CAF。此外,CAF通过增加促炎性细胞因子的分泌来促进肿瘤细胞的一系列特性。研究发现,原发肿瘤细胞与基质细胞之间的双向相互作用是一种新的转移发生机制。
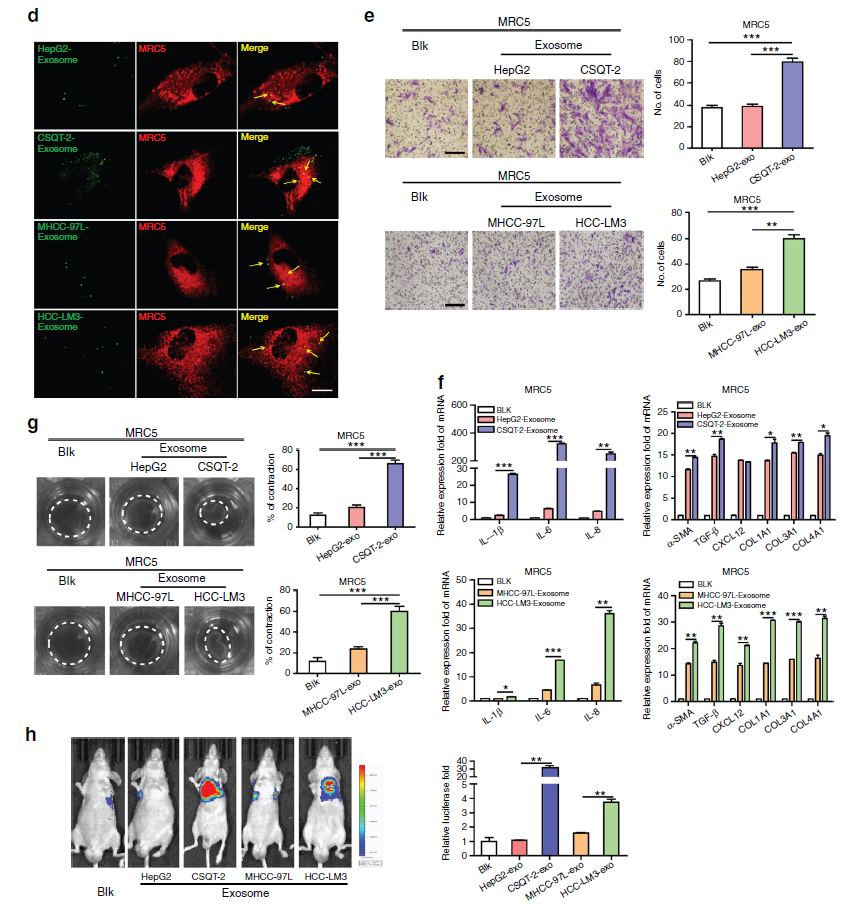
肝细胞癌(HCC)肺转移是肝细胞癌中最常见的侵入类型,是癌症死亡的主要原因之一。该过程涉及由肿瘤微环境中的各种细胞(包括肿瘤细胞和基质细胞)之间的细胞间通讯。靶向肿瘤微环境成分的治疗方式已经成为抗肿瘤转移的有力选择。作为肿瘤基质最丰富的细胞类型,肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)在促进肿瘤进展和转移中起关键作用。由于CAF的来源不同,CAF具有高度的异质性,表现出不同的特异性特点。其中α-平滑肌肌动蛋白(α-SMA)是最常用的CAF标记物。此外,CAF被认为通过表达促炎症基因如IL-1β,IL-6,IL-8,TGF-β,CXCL12和胶原蛋白来调节炎性微环境。肿瘤细胞与CAF之间的通讯已被广泛研究;然而,这种机制在肝癌中的作用并不十分清楚,在肝癌肺转移中就更加不为人所知了。
外泌体,直径为30-100nm,是在细胞多泡体中形成的微囊泡,通过与细胞膜融合将外泌体释放到细胞外环境中。外泌体可以由各种类型的细胞产生,并通过运输信息货物(例如蛋白质、脂质和核酸)作为细胞间通讯的介体。通常使用Tsg101、CD63、Hsp70、CD9和CD81等高度富集的外泌体的特异性蛋白质作为识别外泌体的标志物。大量的研究报道指出,外泌体介导调控肿瘤微环境,促进癌症的转移和进展。
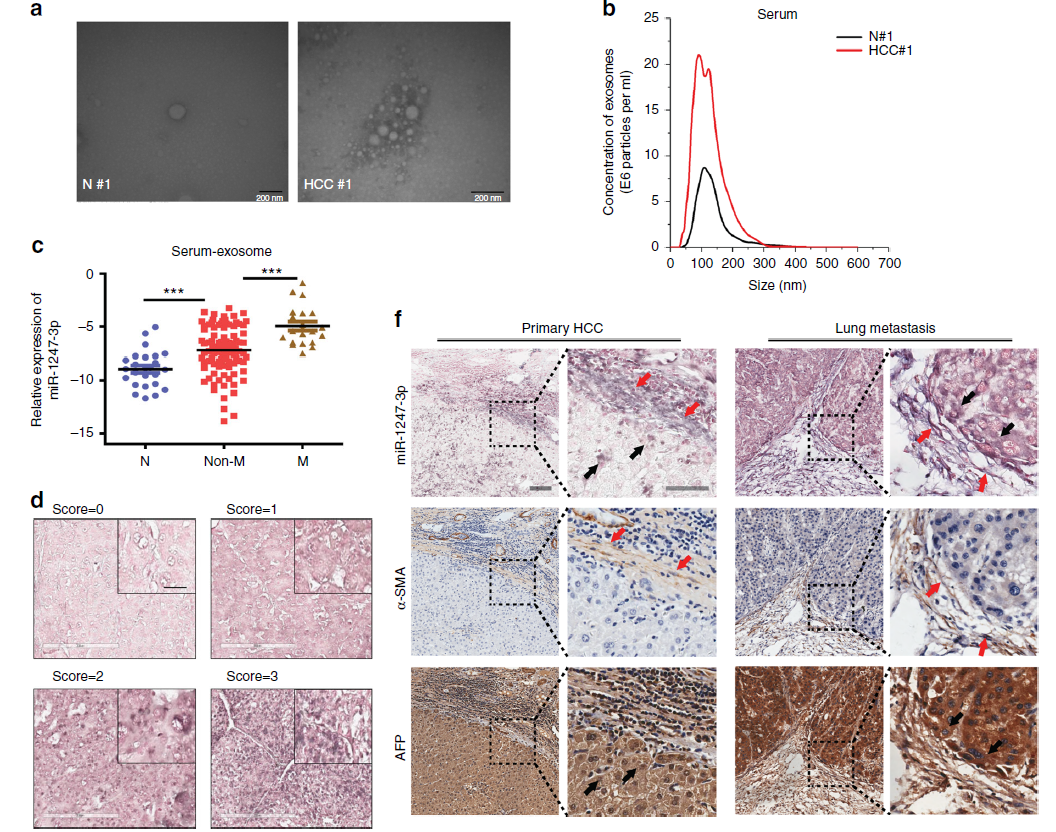
微小RNA(miRNA)是小的非编码RNA,其通过抑制靶mRNA翻译起作用。最近有研究表明,高水平的miRNA和外泌体miRNA已经表现出对多种肿瘤类型的免疫调节、化疗耐药和转移。然而,在肝癌中,肿瘤来源的外泌体miRNA与转移之间的相关性还不清楚。
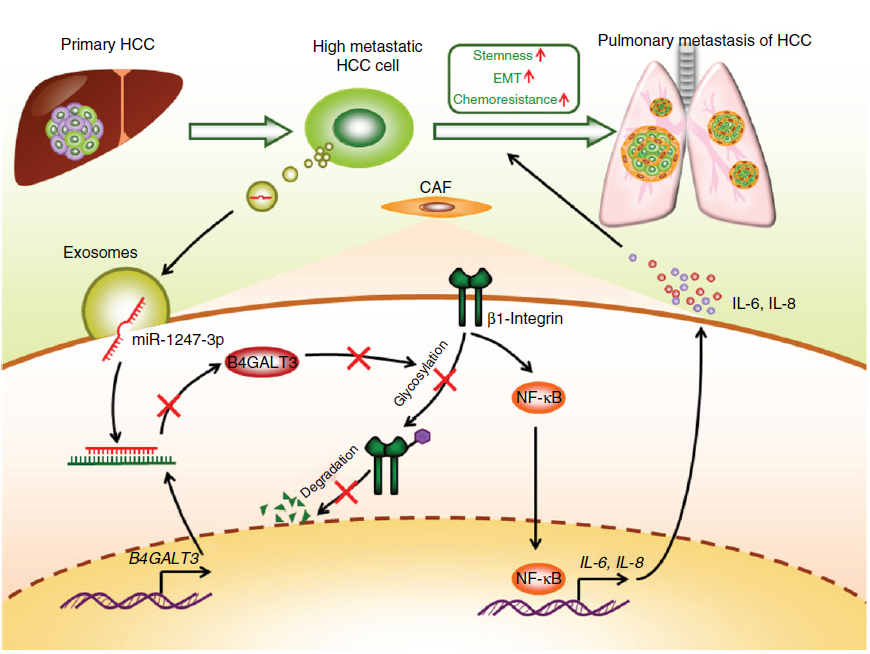
在本研究中,研究人员进一步阐明导致肝癌转移不同程度的原因。在肺转移微环境中,高转移性肝细胞癌(HCC)细胞比低转移性HCC细胞表现出更高的将正常成纤维细胞转化为肿瘤相关成纤维细胞(CAF)的能力。研究人员发现,高转移性HCC细胞分泌的外泌体miR-1247-3p直接靶向B4GALT3,导致成纤维细胞中β1-integrin-NF-κB信号通路的活化。活化的CAF通过分泌促炎症细胞因子(包括IL-6和IL-8)进一步促进癌症进展。临床数据显示血清中高外泌体miR-1247-3p表达水平与HCC患者的转移相关。这些结果表明由肿瘤分泌的外泌体介导的肿瘤细胞和成纤维细胞之间的细胞间通讯,从而调控HCC的转移,该研究为预防和治疗肿瘤转移提供潜在的靶点。
图1:从高转移性肝癌细胞分泌的外泌体调节成纤维细胞活化以促进转移。
图2:MiR-1247-3p与肝癌肺转移的进展密切相关。
参考文献:Fang T, Lv H, Lv G, Li T, Wang C, Han Q, Yu L, Su B, Guo L, Huang S, Cao D, Tang L, Tang S, Wu M, Yang W, Wang H. Tumor-derived exosomal miR-1247-3p induces cancer-associated fibroblast activation to foster lung metastasis of livercancer. Nat Commun. 2018 Jan 15;9(1):191.