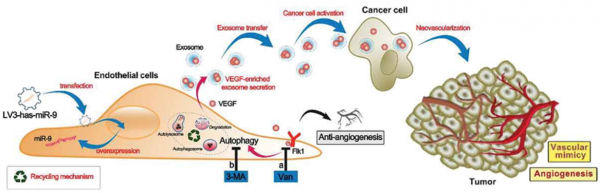
旨在通过抑制肿瘤血管形成和破坏已存在的肿瘤相关血管从而抑制肿瘤的营养摄取过程,通过对肿瘤进行饥饿来治疗肿瘤的策略目前的效果看上去要比最初预期要差。抗血管生成疗法(Anti-angiogenic therapies,AAT)的益处是短暂的,并且已经有研究表明,通过AAT治疗的肿瘤可以通过包括血管共同选择,内皮血管生成和血管生成拟态(VM)等不同形式的血管发生更快地复发。此外,AAT处理的肿瘤血管系统具有更高的渗漏性,这使其易于发生肿瘤细胞侵袭和转移,并在诸如肝细胞癌(HCC)等癌症中引发对AAT的获得性抗性。然而,AAT如何导致肿瘤血管发生仍然是未知的。
近些年的研究表明,小RNA(miRNA)参与调节肿瘤发生和血管发生相关的基因表达。致癌性的miR-9在HCC组织和肿瘤相关内皮细胞(EC)中显着升高。miR-9的高水平表达与HCC患者的不良预后密切相关。据报道,MiR-9可增加肿瘤细胞中血管内皮生长因子(VEGF)的表达,并促进肿瘤血管生成和肺癌和结直肠癌的进展。但这些癌只对miR-9 antagomirs或抗VEGF治疗有中度反应。此外,在AATs中过表达miR-9的肿瘤相关内皮细胞的作用尚不清楚。据报道MiR-9也可以促进自噬过程,这是一种参与清除蛋白质聚集体,细胞器周转以及循环自噬降解副产物的细胞途径。值得注意的是,自噬的诱导促进血管生成,包括VEGF诱导的血管生成,不依赖于营养或缺氧应激。然而,miR-9是否诱导血管生成以及miR-9诱导的血管生成是否受到抗自噬治疗的影响尚未得到充分研究。
在过去的十年中,包括凋亡小体,微泡(MV)和外泌体在内的细胞外囊泡(EV)已经成为健康和疾病中细胞间通信的重要参与者。有研究表明,通过MV递送肿瘤合成的miR-9促进血管内皮细胞迁移。具有脂质双层膜并且在30-150nm大小范围内的外泌体通过血管生成蛋白(例如VEGF)和包括mRNA和miRNA的功能性RNA分子的转移而参与细胞之间的分子交换也被发现报道证实。虽然外泌体在介导肿瘤血管发生中的作用有所报道,但是在AAT之后,外泌体如何参与肿瘤的进展和转移依旧不是十分清楚。
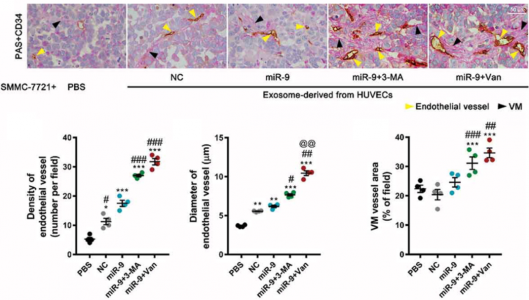
为了阐明AAT后肿瘤血管发生和进展的机制并解决上述相关问题,研究人员首先用miR-9转染人脐静脉内皮细胞(HUVEC)以模拟肿瘤相关的血管内皮细胞。然后检测了miR-9在内皮血管生成和内皮自噬中的作用。之后,研究者们进一步分析了VEGFR2(Flk1)抑制剂vandetanib和自噬抑制剂3-甲基腺嘌呤(3-MA)的抗血管生成作用。最后,研究者们证明HCC的血管生成和进展增强是由于ECs响应抗血管生成和抗自噬治疗而过量表达miR-9并释放富含VEGF的外泌体所导致的。抗血管生成疗法虽然在短期内抑制了血管生成,但是受到刺激的内皮细胞产生了富含VEGF的外泌体,之后促进了肿瘤中内皮细胞的血管生成,同时增强了肿瘤细胞血管拟态的发生。最终,一系列过程的影响导致抗血管生成疗法的预后不佳。
肿瘤抗血管生成疗法是较为经典的治疗策略,最初在1971年,由哈佛大学Judah Folkman提出。目前已经有多种抗血管生成相关的肿瘤药物应用于临床,但抗血管生成疗法依旧存在着诸如治疗效果不理想等诸多问题,其背后机制有待进一步阐释。这篇文章阐释了抗血管生成疗法过程中肿瘤相关内皮细胞通过释放富含VEGF的外泌体来促进肿瘤内血管生成,尤其是肿瘤血管拟态的发生,从而降低抗血管生成疗法的疗效。这对我们进一步完善抗血管生成疗法提供了很好的理论基础和潜在的靶向策略。
该文章由四川大学华西基础医学和法医学院的曾烨研究员与纽约城市大学的Bingmei M. Fu合作完成。两人为共同通讯作者。
曾烨研究员的其他代表性成果请参考:https://www.researchgate.net/profile/Ye_Zeng3
参考文献:Anti-angiogenesis triggers exosomes release from endothelial cells to promote tumor vasculogenesis. J Extracell Vesicles 8:1629865.