淋巴管生成在炎症性肠病(IBD)的发病机制中起重要作用,血管内皮生长因子-C(VEGF-C)是一种强大的淋巴管生成因子。脂肪来源的干细胞(ADSCs)可以分泌生长因子和外泌体,调节受疾病影响的恶劣微环境。然而,外泌体对VEGF-C依赖性淋巴管生成的作用及其机制尚不清楚。近日,来自同济大学附属上海第十人民医院的王晓蕾研究组在Cell Physiol Biochem.杂志发表文章,他们发现,VEGF-C处理后ADSCs分泌的miR-132可以通过外泌体转移到淋巴管内皮细胞,并且这种摄取导致细胞增殖、迁移和微管形成。 miR-132通过直接靶向Smad7并激活TGF-β/Smad信号传导来调节VEGF-C依赖性淋巴管生成反应。
炎症性肠病(Inflammatory bowel disease,IBD)是一种复杂的疾病,其发病涉及遗传、环境、微生物和免疫因素。越来越多的证据表明微血管通过改变白细胞募集、淋巴管生成和血管生成导致组织重塑从而导致慢性炎症,因此在IBD的病理生理学中起着至关重要的作用。
淋巴管生成在一些情况下的成体组织中发生,诸如炎症、伤口愈合和肿瘤转移的病理状况中,并且是肠、皮肤、心脏和气管中炎症过程的标志之一。淋巴管生成可以促进组织水肿的消退和急性和慢性炎症环境中炎症细胞的动员。但是,淋巴管生成也可能给免疫疾病带来不良影响,例如移植后的排斥反应。因此,淋巴管生成反应可能在病理状况中产生有害或有益的反应,这取决于潜在疾病的病理生理学机制。新兴研究已将淋巴管生成确定为慢性肠道炎症的标志性特征,并假设其介导的血管种群的扩张在IBD中发挥致病作用。
血管内皮生长因子-C(VEGF-C)是最强大的促淋巴管生成因子。淋巴管生成是通过VEGF-C与VEGFR-3的结合介导的。 VEGF-C过表达显著诱导淋巴管生成并降低原发性淋巴水肿小鼠模型中的水肿程度。此外,IBD动物模型中的抗淋巴治疗已显示加重炎症和粘膜下水肿,并导致白细胞浸润增加。
脂肪来源的干细胞(ADSCs)是一种丰富且易于获得的多能祖细胞群,其存在于脂肪组织中。ADSCs具有分泌生长因子和外泌体的能力,在临床前研究和几种疾病的实验性临床试验中的治疗用途已被充分证明。外泌体,一种30-150nm大小的细胞外囊泡,含有核酸和蛋白质,在组织中充当信使作用并向近距离和远距离细胞提供因子和信号分子。据报道,间充质干细胞(MSCs)分泌的外泌体通过转移miR-125a促进内皮细胞血管生成。来自ADSC的外泌体改善亨廷顿病体外模型的表型。ADSCs还具有在体外促进淋巴管内皮细胞增殖、迁移和微管形成的潜力。然而,外泌体在介导VEGF-C与ADSC的相互作用和随后的淋巴管生成中的作用仍不清楚。
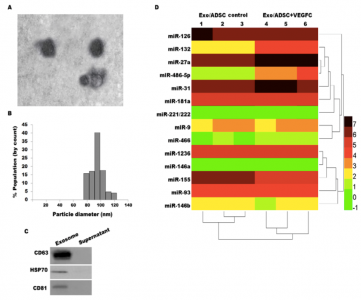
基于上述研究基础,本研究探讨了来自ADSC的外泌体是否调节VEGF-C依赖性淋巴管生成反应。在含或不含重组VEGF-C的培养基中培养ADSC,从条件培养基中提取外泌体。用ADSCs衍生的外泌体处理淋巴内皮细胞(LEC),然后分别使用细胞计数试剂盒-8(CCK-8)、transwell小室和基于matrigel的微管形成测定法测定LEC的增殖、迁移和微管形成。结果发现,VEGF-C处理的ADSCs(ADSCs / VEGF-C)中分离的外泌体中的miR-132水平显著高于来自ADSC对照组。外泌体介导miR-132直接从ADSC转移至LEC。来自ADSCs / VEGF-C的外泌体比来自ADSC对照细胞的外泌体更有效地促进LEC的增殖、迁移和微管形成,而用miR-132抑制剂预处理ADSC减弱了VEGF-C依赖性淋巴管生成反应。最后,研究人员揭示了miR-132通过直接靶向Smad-7和调节TGF-β/ Smad信号传导来促进淋巴管生成反应。这些数据为ADSCs衍生的外泌体作为VEGF-C依赖性淋巴管生成的重要参与者的作用提供了新的见解。
图:来自ADSC / VEGF-C的外泌体中miR-132高表达
参考文献:Wang X, Wang H, Cao J, Ye C. Exosomes from Adipose-Derived Stem Cells Promotes VEGF-C-Dependent Lymphangiogenesis by Regulating miRNA-132/TGF-β Pathway. Cell Physiol Biochem. 2018 Aug 22;49(1):160-171.