作者:企鹅
肿瘤脉管系统是一个有吸引力的治疗靶标。卵巢癌的逐渐增长和恶性腹水的形成严重依赖于血管生成的这一事实表明,抗血管生成治疗策略可能对卵巢癌治疗具有功效。尤其是,腹水作为恶性肿瘤并发症的负担仍然非常重要,因为其程度是侵袭性和转移潜能的特征,并且是预后不良的重要指标。目前的腹膜穿刺术在解决液体积聚的根本原因方面并不有效,并且具有显著的副作用风险。由于其在肿瘤血管生成中的中心作用,血管内皮生长因子(VEGF)已经成为最重要的血管生成靶标。VEGF在大多数卵巢癌中过表达。然而,尽管靶向VEGF已经被发现具有早期临床益处,但大多数患者最终经历了抵抗和疾病进展的发展,这表明需要具有其他机制的其他血管生成调节剂。
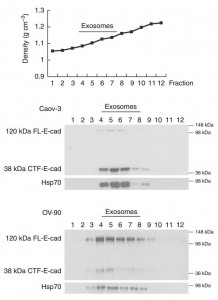
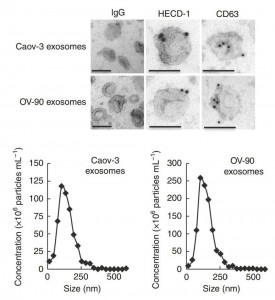
转移进展的标志之一是钙粘蛋白(主要细胞-细胞粘附分子)的动态调节,其在该过程的各个方面(包括细胞生长、侵袭和迁移)中发挥关键作用。尽管E-钙粘蛋白被合成为跨膜分子(120 kDa糖蛋白),但它可以从胞外域切割并以可溶形式(sE-cad; 80-kDa)释放,这归因于细胞表面的功能E钙粘蛋白。这在过去很大程度上被忽略,因为sE-cad只能通过检测蛋白质印迹上的蛋白质大小来检测。重要的是,sE-cad在卵巢癌的血清和腹水中高表达(6.18-89.56μgmL-1)并预测预后不良。这些观察结果强调了解sE-cad在卵巢癌中的作用的重要性。一般来说,sE-cad只能用于减弱细胞间粘附。目前还没有关于sE-cad是否具有生物学功能本身的信息,这对于决定转移扩散至关重要。此外,sE-cad的释放仅仅表现为胞外域脱落的机制。尽管发现sE-cad是由肿瘤本身产生的,但还不清楚是否存在其他剪切事件。
来自香港大学生物科学学院的副院长黄思齐教授(Dr. Alice Sze-Tsai Wong)团队第一次在体外和体内证明了sE-cad是血管生成的关键调节剂。还提供证据证明外泌体是在此过程中切割和释放sE-cad的新型主要平台。
蔗糖密度梯度离心结合WB证明sE-cad存在于外泌体上
电镜证明sE-cad存在于外泌体上及外泌体的纳米颗粒分析
摘要:
目前的抗血管生成疗法的局限性需要具有其他机制的其他靶标。该研究第一次展示了在卵巢癌患者的恶性腹水中高度表达的可溶性E-钙粘蛋白(sE-cad)(80-kDa可溶形式)是血管生成的有效诱导剂。除了胞外域脱落之外,还提供了进一步的证据,表明sE-cad以外泌体形式大量释放。从机制上看,sE-cad阳性的外泌体介导内皮细胞上的VE-钙粘蛋白异源二聚化并转导β-连环蛋白和NFκB信号传导的新型顺序激活。体内和临床数据证明了sE-cad阳性外泌体对于恶性腹水形成和广泛的腹膜扩散的相关性。这些数据推动我们对卵巢癌血管生成的分子调控的理解,并支持靶向sE-cad的治疗潜力。卵巢癌通过外泌体的sE-cad释放可能是诊断和预后的生物标志物。
通讯作者:
黄思齐教授(Dr. Alice Sze-Tsai Wong)目前是香港大学生物科学学院的副院长。黄思齐博士是一个癌症生物学家,主要研究领域包括β-catenin在细胞粘附和癌症中的作用及信号转导调控。最近还阐述了p70 S6激酶的新的作用,这是mTORC1下游的重要介导分子,在许多癌细胞中过度激活。她在有重要影响的杂志(Top 15%)上发表了大量文章,还获得许多重要奖项(包括裘槎基金资深研究学者奖,妇女科学家Brigid G. Leventhal Award, 美国癌症研究协会Bristol-Myers Squibb Oncology青年科学家奖等),在其研究领域具有重要的学术地位。
参考文献:
Tang MKS, Yue PYK, Ip PP, Huang RL, Lai HC, Cheung ANY, Tse KY, Ngan HYS, Wong AST. Soluble E-cadherin promotes tumor angiogenesis and localizes to exosome surface. Nat Commun. 2018 Jun 11;9(1):2270. doi: 10.1038/s41467-018-04695-7.