1月22日,国际著名期刊Nature Immunology(IF=21.506)在线发表了来自浙江大学生命科学研究院的张龙研究员(细胞信号网络协同创新中心)与苏州大学生物医学研究院特聘教授周芳芳合作的最新研究发现,揭示了肿瘤来源的外泌体抑制宿主先天抗病毒免疫的机制。
细胞信号网络协同创新中心(Innovation Center for Cell Signaling Network)组建于2012年8月,由厦门大学牵头,浙江大学、中国科学技术大学、中国科学院上海生命科学研究院生物化学与细胞生物学研究所和上海药明康德新药开发有限公司作为核心单位共同组建。
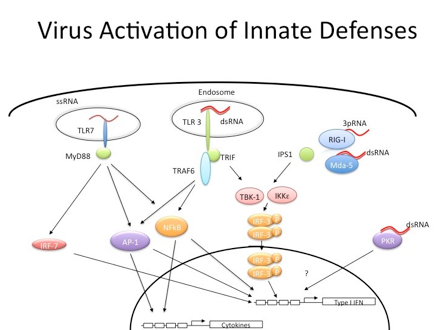
感染后,生殖系(germline)编码的模式识别受体识别入侵病毒的病原体相关分子模式,并启动一系列导致产生I型干扰素和促炎因子的信号传导途径。识别这些病毒核酸的模式识别受体包括TLRs、RIG-I样受体和某些DNA传感器,如cGAS和IFI16。在识别病毒核酸之后,模式识别受体募集下游适配器(adaptors),包括TRIF、MAVS和STING。这些适配器随后激活下游激酶TBK1和IKKε。然后TBK1和IKKε激活转录因子NF-κB和IRF3,IRF3转位到细胞核并诱导I型干扰素(一种对宿主保护必需的细胞因子家族)的表达。
外泌体是在后期胞内体中合成并通过各种细胞类型释放到细胞外环境中的小膜囊泡(直径30-100 nm)。外泌体包含功能性生物分子(蛋白质、脂质、RNA和DNA),可以转移到受体细胞。越来越多的研究揭示肿瘤来源的外泌体(tumor-derived exosomes, TEXs)是肿瘤发生的调节者。从黑色素瘤分泌的外泌体在骨转移前的生态位中将骨髓祖细胞重编程为促血管生成表型。TEX与嗜中性粒细胞和嗜酸性粒细胞的募集、自然杀伤细胞的增殖以及参与癌症微环境适应的巨噬细胞的激活有关。已有报道发现存在于外泌体中的特定蛋白质可以决定器官特异性转移和癌症患者的存活。另外,TEXs向免疫细胞传递抑制或激活的分子信号,直接或间接影响细胞的发育、成熟和抗肿瘤活性。然而,TEXs是否影响宿主的先天性抗病毒免疫仍不清楚。
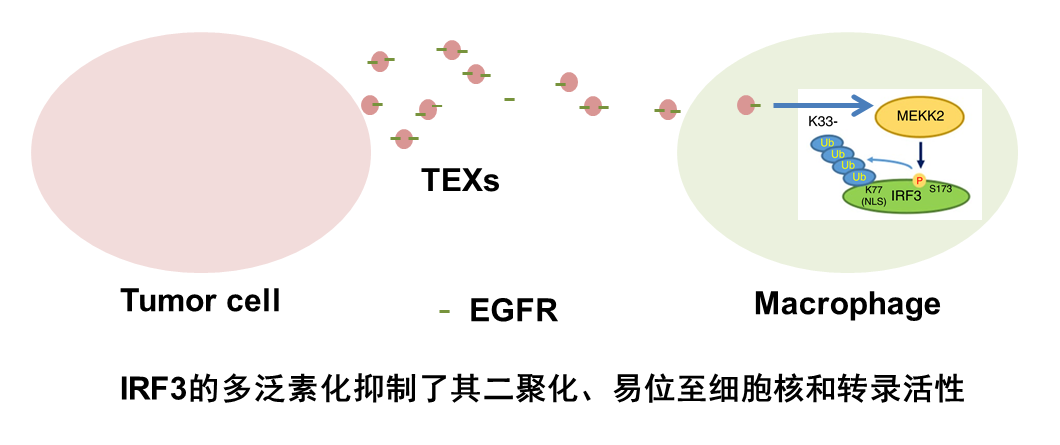
该研究发现,TEX能够将活化的表皮生长因子受体(EGFR)转移到宿主巨噬细胞中,进而参与巨噬细胞内源的信号通路,减少I型干扰素的产生和抗病毒免疫力。这些结果证明了肿瘤细胞抑制宿主免疫功能的机制。
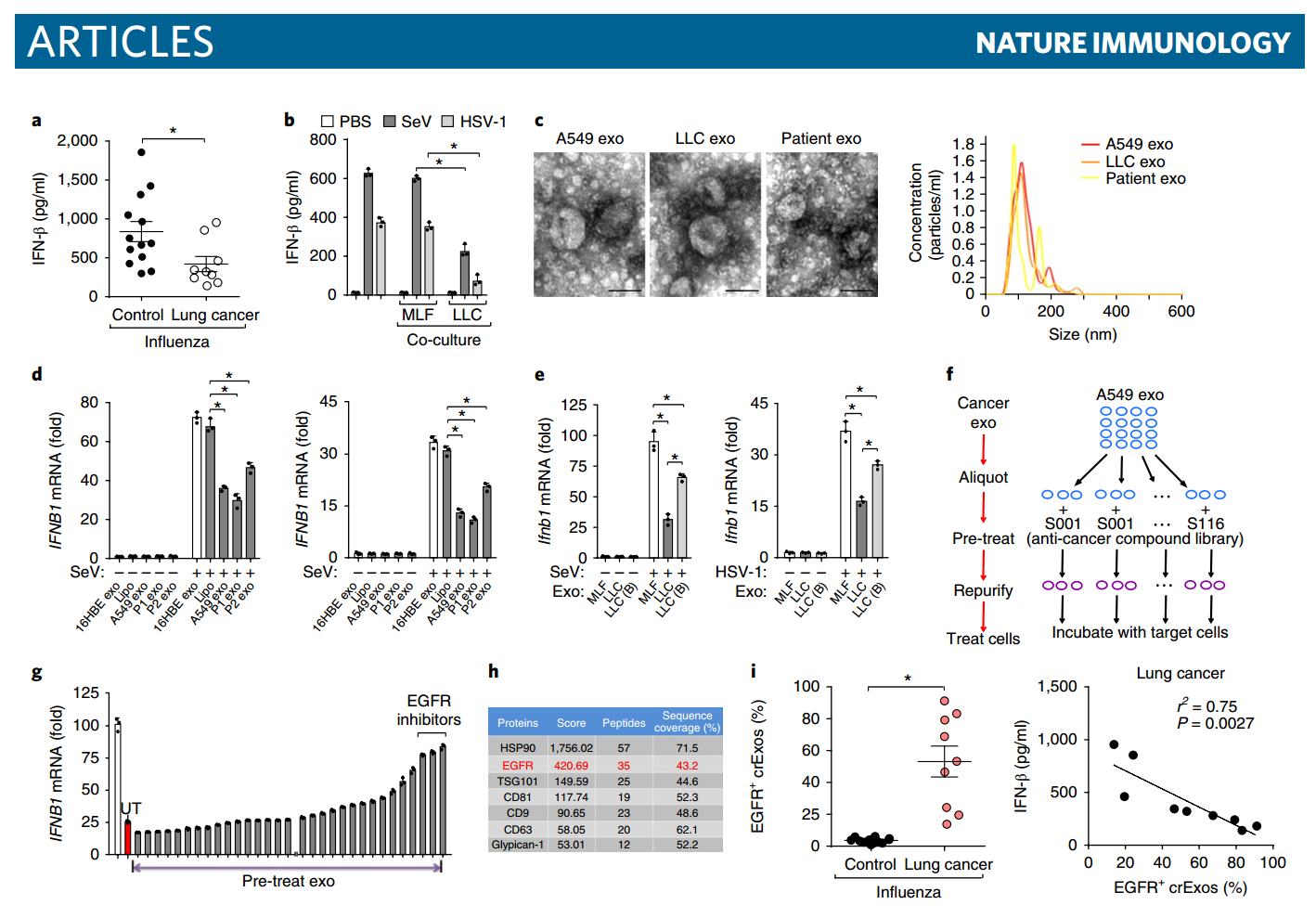
TEXs抑制先天抗病毒免疫 在流感患者中,无癌症患者的血清干扰素-β(IFN-β)浓度显著高于未接受化疗的肺癌患者(图1a)。这提示IFN-β信号传导可能受到肺癌的损害。为了研究肿瘤生长是否会影响宿主的天然抗病毒免疫,研究人员使用聚碳酸酯膜插入物将RAW264.7小鼠巨噬细胞与小鼠Lewis肺癌(LLC)细胞或非癌性小鼠肺成纤维细胞(MLF)(对照细胞)一起培养,并避免两种细胞类型之间的直接接触。由RNA病毒仙台病毒(SeV)或DNA病毒单纯疱疹病毒1型(HSV-1)诱导的IFN-β分泌在用LLC细胞培养的RAW264.7细胞中显著低于“同样”培养的RAW264.7细胞(单独培养)或用MLF培养的RAW264.7细胞(图1b)。从A549细胞和LLC细胞以及来自患者衍生的原发性肺癌细胞和MDA-MB-231人类乳腺癌细胞中分离外泌体(图1c和数据未显示)。这些(肿瘤来源的)外泌体对THP-1细胞的预处理显著降低了SeV-或HSV-1诱导的IFNB1 mRNA的丰度(图1d和补充图1e)。热变性降低了TEXs的这种抑制效应(图1e),这表明TEXs中包含的蛋白质组分在这方面是重要的。为了确定哪种蛋白质对于TEX介导的天然免疫抑制是关键的,我们用靶向关键致癌蛋白质的116种小分子抗癌化合物的文库(图1f)处理了A549细胞衍生的外泌体。值得注意的是,用EGFR抑制剂预处理的A549细胞衍生的TEX失去了抑制THP-1细胞的抗病毒反应的能力(图1g)。质谱分析证实EGFR在A549细胞的外泌体和MDA-MB-231癌细胞(图1h和补充图1f)的外泌体中大量存在,但是在正常肺成纤维细胞(MLF)的外泌体中不存在EGFR。流式细胞术显示肺癌患者的EGFR+循环外泌体(crExos)的比例远高于无癌症患者(对照受试者),后者几乎无法检测到(图1i)。此外,在肺癌和流感患者中,IFN-β的产生与EGFR + crExos的丰度呈显著负相关。这些结果表明,肿瘤细胞可能通过分泌EGFR+外泌体而损害宿主先天性抗病毒免疫。
论文摘要:
恶性肿瘤损害天然免疫,但其机制在很大程度上是未知的。该研究发现通过肿瘤来源的外泌体(TEXs),癌症能够转移活化的表皮生长因子受体(EGFR)至宿主巨噬细胞,从而抑制先天的抗病毒免疫。人蛋白激酶组的筛选鉴定了巨噬细胞中的激酶MEKK2,作为TEX递送EGFR的效应器,可负调节抗病毒免疫应答。在实验性肿瘤植入的背景下,MEKK2缺陷小鼠比野生型小鼠对病毒感染更具抗性。将TEX注射到小鼠中降低先天免疫,增加病毒载量并以EGFR和MEKK2依赖性方式增加发病率。MEKK2磷酸化IRF3,一种对产生I型干扰素至关重要的转录因子;这触发了IRF3的多泛素化,并且阻断了其病毒感染后的二聚化、易位至细胞核和转录活性。这些发现确定了一种机制,通过这种机制,癌细胞可以抑制宿主先天免疫,并可能使癌症患者的免疫受损。
模式图(小编极简版)
小编按:
据小编文献库记录,这是外泌体领域国内目前为止发表的第4篇影响因子20分以上大paper。期待后续更多重磅研究发现!前3篇为:
1. 复旦大学袁正宏教授:外泌体介导IFN-alpha诱导的抗病毒活性的细胞间传递
Li, J., et al. (2013). "Exosomes mediate the cell-to-cell transmission of IFN-alpha-induced antiviral activity." Nat Immunol 14(8): 793-803.
2. 第二军医大学王林辉教授、王红阳院士等发现外泌体中具有传递肿瘤抗药性功能的lncRNA
Qu, L., et al. (2016). "Exosome-Transmitted lncARSR Promotes Sunitinib Resistance in Renal Cancer by Acting as a Competing Endogenous RNA." Cancer Cell.
3. 第二军医大学曹雪涛研究团队揭示肿瘤外泌体促进肺促转移“龛”结构形成新机制
Liu, Y., et al. (2016). "Tumor Exosomal RNAs Promote Lung Pre-metastatic Niche Formation by Activating Alveolar Epithelial TLR3 to Recruit Neutrophils." Cancer Cell 30(2): 243-256.
该文内容参考文献:
Liang Gao, Lin Wang, Tong Dai, Ke Jin, Zhengkui Zhang, Shuai Wang, Feng Xie, Pengfei Fang, Bing Yang, Huizhe Huang, Hans van Dam, Fangfang Zhou & Long Zhang. Tumor-derived exosomes antagonize innate antiviral immunity. Nature Immunology (2018) doi:10.1038/s41590-017-0043-5
外泌体资讯网 【Nature Immunology】浙大张龙组与苏大周芳芳组合作发现肿瘤外泌体抑制宿主先天抗病毒免疫的机制丨国内外泌体大paper+1