外泌体作为一种新型细胞间信息交流的方式,引起了研究者的极大兴趣,一直以来外泌体被认为是细胞代谢的废弃物而被研究人员所忽视。随着研究的深入,逐渐发现外泌体作为重要的细胞间信息物质的交换的工具所存在,尤其在肿瘤的发生发展中,ncRNA外泌体扮演重要角色,表明可能存在特定的RNA分选机制。相应的,细胞内MVBs生成之后,并不是参与自噬,而是与细胞膜融合释放出外泌体,这表明可能存在特定的MVBs分泌调控的机制。循环外泌体在被受体细胞识别和吸收后,促进肿瘤的发生发展,同时给肿瘤早期液体活检和治疗带来了新的可能。外泌体作为生物载体参与靶向治疗已经被证实,然而在药剂的负荷装载中可能存在我们所不知的特定的开关。本综述着重回顾,控制ncRNA的分选和吸收的机制;MVBs分泌调控的分子机制;同时还回顾了ncRNA外泌体在促进肿瘤发生发展中的作用和外泌体在诊断治疗方面的前景!
Highlight
- 外泌体生成,释放和摄取的机制
- MVBs去向可能暗示在自噬和外泌体分泌中存在特定调控机制
- 外泌体ncRNAs在细胞间通讯中起重要的促进肿瘤进展作用
- 外泌体在癌症诊断和治疗中有重要应用前景
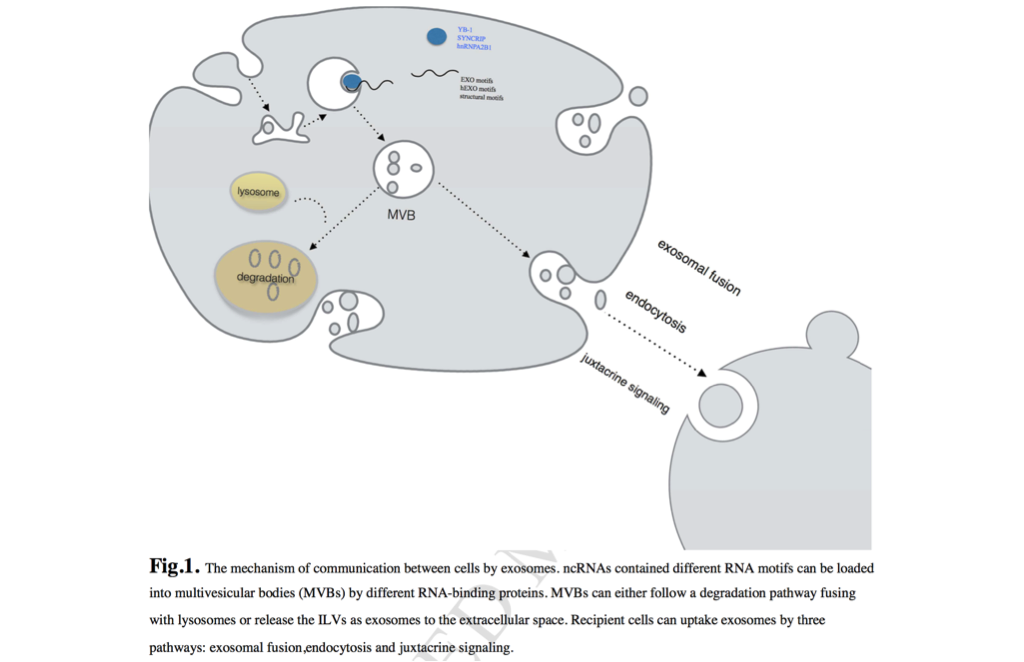
图一 外泌体细胞之间的信息交流机制。含有不同RNA基序的ncRNAs可以通过不同的RNA结合蛋白加载到多泡体(MVBs)中。MVBs与溶酶体融合降解途径或将ILVs作为外秘体释放到细胞外空间。受体细胞可以通过三种途径摄取外泌体:直接融合,内吞和旁分泌信号传导。
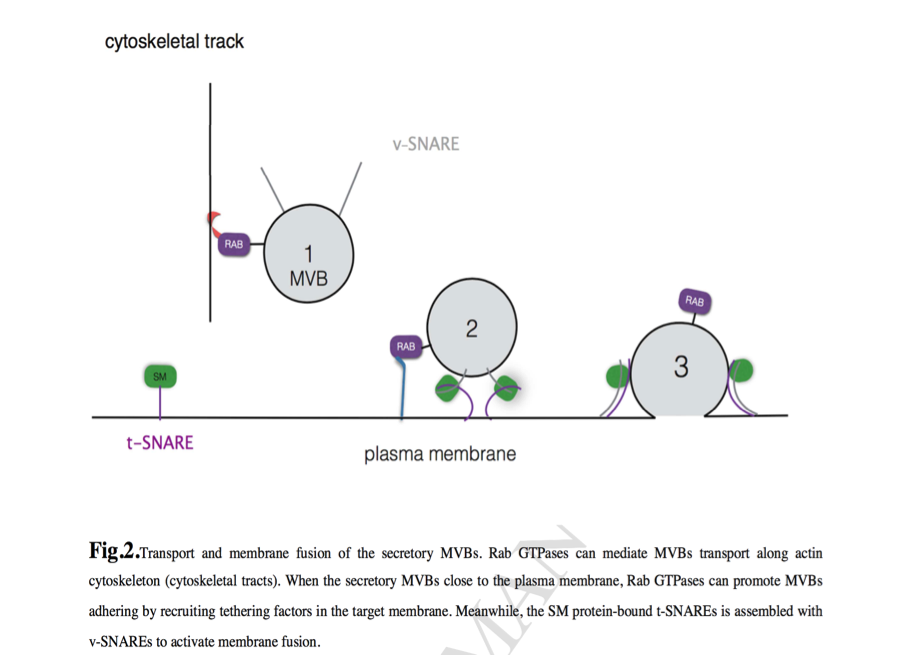
图二 分泌性MVB的运输和质膜融合。Rab GTPases可以介导MVBs沿着肌动蛋白细胞骨架(细胞骨架)传输。 当分泌型MVB靠近质膜时,Rab GTPases可以通过在目标膜中募集系链因子而促进MVB粘附。同时,将SM蛋白结合的t-SNAREs与v-SNAREs组装以激活膜融合。
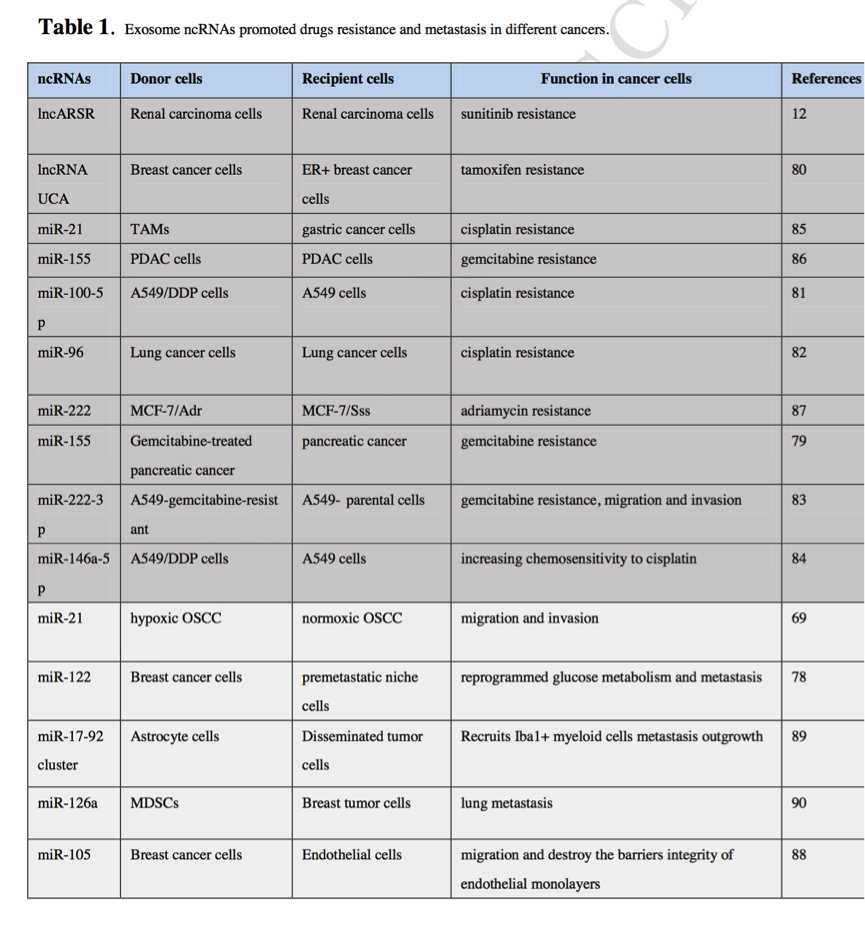
表1 外泌体ncRNAs促进了不同癌症的药物耐药和转移。
参考文献:
Fan Q, Wei S, Yang L, Zhang X, Peng X, Su D, Zhai Z, Hua X, Li H. The emerging role of exosome-derived non-coding RNAs in cancer biology. Cancer Lett. 2017 Oct 2. IF= 6.375