1. 第二军医大学邢新教授等:脐带MSC外泌体miRNAs抑制伤口愈合过程中的瘢痕过度形成
Fang S, Xu C, Zhang Y, et al. Umbilical Cord-Derived Mesenchymal Stem Cell-Derived Exosomal MicroRNAs Suppress Myofibroblast Differentiation by Inhibiting the Transforming Growth Factor-β/SMAD2 Pathway During Wound Healing[J]. Stem Cells Translational Medicine, 2016: sctm. 2015-0367. IF=4.247
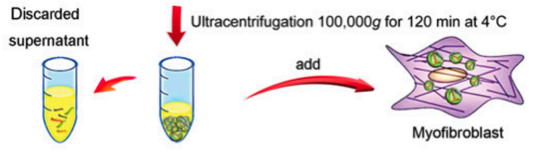
肌成纤维细胞聚集造成的瘢痕形成过度在皮肤伤口愈合过程中有重要的临床意义。研究表明,间充质干细胞(MSCs)可以促进皮肤再生,但MSCs是否有助于形成疤痕仍然不确定。第二军医大学邢新教授等研究发现,脐带来源的MSC(uMSCs)在皮肤缺损小鼠模型可减少瘢痕形成和肌成纤维细胞的积累。这些功能主要是依赖于uMSCs来源的外泌体(UMSC-Exos),尤其是外泌体的microRNAs。通过高通量RNA测序和功能分析,证明了uMSC-Exos富含一组microRNAs(miR-21,-23a,-125b和-145),通过抑制TGF-β2/SMAD2信号通路抑制肌成纤维细胞的形成。最后,使用他们自己建立的阻止外泌体内部miRNA的策略,发现这些特定的外泌体miRNAs对于uMSCs在体外和体内抑制肌成纤维细胞生长和抗瘢痕形成的功能是必不可少的。该研究揭示了外泌体miRNA在uMSC介导治疗过程中起重要作用,这表明uMSC的外泌体的临床应用可能是防止伤口愈合时瘢痕形成的一个策略。
该研究的重要性:
外泌体是脐带间质干细胞(uMSCs)释放的一种重要成分,是细胞与细胞之间通信的重要介质。然而,目前还不清楚是MSC外泌体内的哪个或哪组成分介导了肌成纤维细胞的功能,特别是在创伤修复过程中。本研究探讨了uMSC外泌体miRNA在肌成纤维细胞形成的过程导致过度的疤痕的作用机制。uMSC外泌体的这一功能尚未报告。此外,本研究第一次报道了,通过高通量测序分析uMSC外泌体miRNAs,发现在一组特定的microRNAs(miR-21,-23a,-125b和-145),通过抑制TGF-β2/SMAD2信号通路抑制α平滑肌肌动蛋白和胶原过量沉积,从而抑制肌成纤维细胞的形成。
2. 浙江大学曹利平教授:胆管癌外泌体通过抑制TNF-α 与穿孔素分泌使细胞因子诱导的杀伤细胞抗肿瘤活性下降
CHEN J, XIANG J, DING G, et al. Cholangiocarcinoma derived exosomes inhibit the antitumor activity of cytokine-induced killer cells by down-regulating the secretion of TNF-α and perforin[J]. Journal of Zhejiang University Science B, 2016, 1.
目 的:探索胆管癌来源外泌体(TEX)对细胞因子诱导的杀伤细胞(CIK)抗肿瘤活性的影响,并初步探讨其作用机制。
创新点:首次通过体外实验证明 TEX 可引起 CIK 抗肿瘤活性下降,且此作用与肿瘤坏死因子 α(TNF-α)和穿孔素表达抑制相关。
方 法:采用超速离心法提取人胆管癌细胞(RBE)来源的外泌体,同时CIK 通过人外周血培养获得。将TEX 负载到 CIK 培养体系中作为 TEX-CIK不加 TEX 的 CIK 作为N-CIK组。流式细胞仪检测两组 CIK 细胞表型变化,酶联免疫吸附法(ELISA)检测两组培养基上清液中TNF-α和穿孔素的浓度, CCK-8法检测 CIK 对 RBE 细胞的杀伤活性。
结 论:该研究揭示了,RBE细胞(人胆管癌细胞系)来源的外泌体通过下调CD3+、CD8 +、NK(CD56 +)和CD3 + CD56 +细胞群和TNF-α、穿孔素的分泌,抑制CIK(cytokine-induced killer)细胞的抗肿瘤活性。 RBE细胞来源的外泌体可能在胆管癌免疫逃逸中起重要作用。
3. 中国医学科学院放射医学研究所/苏州大学医学部周平坤教授等:外泌体参与辐射诱导的旁效应
Song M, Wang Y, Shang Z F, et al. Bystander autophagy mediated by radiation-induced exosomal miR-7-5p in non-targeted human bronchial epithelial cells[J]. Scientific Reports, 2016, 6. IF=5.228
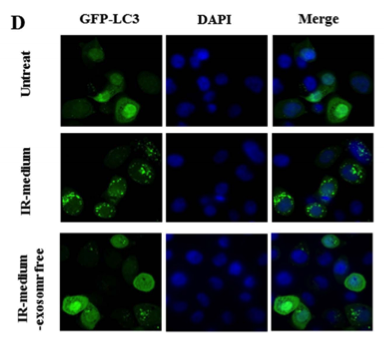
辐射诱导的旁效应(RIBE)是指非靶向细胞接收来自被照射细胞的旁信号后所带来的一组生物效应。RIBE将放射治疗的潜在危害带到邻近正常组织,比以前认为的风险更高。被照射细胞过度释放一些物质进入胞外微环境后具有有害影响。例如,细胞因子和活性氧(ROS)已被证实通过细胞外介质或间隙连接参与RIBE。然而,RIBE介导信号和细胞间的沟通途径仍未研究清楚。该研究首先确定了一组2 Gy照射的人支气管上皮BEP2D细胞来源的外来体中差异表达的miRNAs,其中miR-7-5p参与诱导受体细胞的自噬。这种外泌体介导的自噬可被miR-7-5p抑制剂显著减弱。此外,数据显示,外泌体miR-7-5p诱导的自噬与EGFR/AKT/mTOR信号通路相关。总之,该研究发现外泌体参与辐射诱导的旁效应(RIBE)的传递。外泌体miR-7-5p是自噬旁效应的关键因子。
4. 山西大学李卓玉教授乙酰化修饰促进结肠癌GRP78的外泌体分泌
Li, Z., et al. (2016). "Acetylation modification regulates GRP78 secretion in colon cancer cells." Sci Rep 6: 30406. IF=5.228
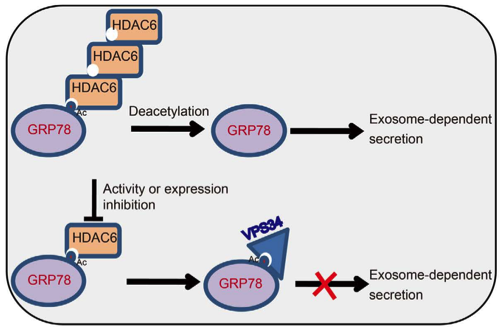
山西大学李卓玉教授团队发现GRP78会从结肠癌细胞通过外泌体分泌。组蛋白去乙酰化酶(HDAC)抑制剂会通过促使GRP78在ER的聚集从而阻断GRP78的释放。在机制上,HDAC抑制剂的处理会抑制HDAC6的活性,并导致GRP78乙酰化的增加;之后乙酰化的GRP78会结合VPS34(一种III型3-磷酸肌醇激酶),从而阻止GRP78进入多泡体(MVBs)。值得注意的是,我们发现,利用谷氨酰胺代替633位赖氨酸残基位点,这是HDAC6的去乙酰化位点之一,这种模拟的乙酰化方式可以使得GRP78乙酰化的下降,并导致GRP78分泌以及恢复体外肿瘤细胞的生长。因此,研究人员的研究揭示了GRP78分泌的一些迄今未知的机制,并且还可以提供利用HDAC抑制剂用于治疗用途的潜在价值。
详情可点击查看之前推文:http://mp.weixin.qq.com/s?__biz=MzI2MTAzMTI4MQ==&mid=2651828759&idx=1&sn=43347b4da050ad57e80ba40394565cc3#rd
5. 徐州医科大学附属医院崔桂云教授:miR-145调节糖尿病大鼠骨髓间充质干细胞的神经修复作用
Cui C, Ye X, Chopp M, et al. miR-145 Regulates Diabetes-Bone Marrow Stromal Cell-Induced Neurorestorative Effects in Diabetes Stroke Rats[J]. Stem Cells Translational Medicine, 2016: sctm. 2015-0349. IF=4.247
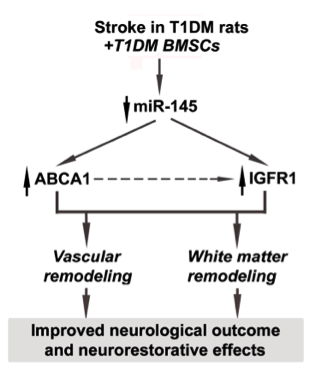
该研究在1型糖尿病(T1DM)大鼠的体内实验中比较了T1DM大鼠的骨髓间充质干细胞(DM-BMSCs)和正常大鼠来源的骨髓基质细胞(Nor-BMSCs)对中风的治疗效果及其作用机制。在体外实验中,DM-BMSCs及其外泌体的miR-145表达下调,促进DM-BMSC存活、毛细管形成、轴突的生长,Nor-BMSCs及其外泌体没有这些功能,过表达miR-145的DM-BMSCs也失去这些功能。在体内,与Nor-BMSCs和PBS处理相比,DM-BMSC治疗改善功能和血管、白质重塑,降低血清miR-145表达,并增加miR-145靶基因ABCA1和IGFR1的表达。microRNA-145介导了DM-BMSC的治疗作用。
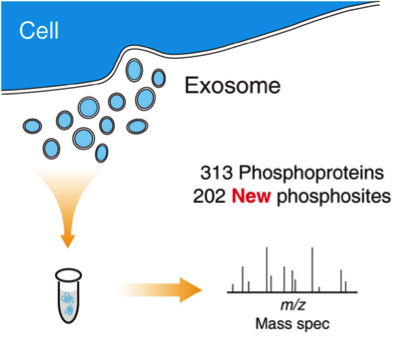
6. 暨南大学王通教授、何庆瑜教授:人外泌体的质谱分析发现新的蛋白磷酸化位点
Guo, J., et al. (2016). "Phosphoproteome Characterization of Human Colorectal Cancer SW620 Cell-Derived Exosomes and New Phosphosite Discovery for C-HPP." J Proteome Res. IF=4.137
鉴定已知蛋白的所有磷酸化形式是以染色体为中心的人类蛋白质组项目(C-HPP)的一个主要目标。最近的研究发现,某些磷蛋白可以包装在外泌体中,并在肿瘤微环境中起关键作用。但是,人外泌体的磷酸化蛋白目前没有详细研究,这使得外泌体成为新磷酸化位点发现的潜在来源。该研究对人类结肠癌SW620细胞外泌体蛋白及细胞蛋白做了详细的质谱分析。通过严格的数据质量控制,该研究在SW620外泌体中鉴定了313种磷酸化蛋白和1091个磷酸化位被理直气壮地位点,其中202个是新的磷酸化位点。外泌体磷酸化蛋白显著集中在11号染色体的11q12.1-13.5区域,酪氨酸磷酸化蛋白丰度较高(6.4%),这些与肝配蛋白信号传导途径介导细胞骨架重构功能相关的。总之,该研究第一次报道了人细胞分泌的外泌体的磷酸化蛋白高覆盖度分析结果。该发现揭示了外泌体磷蛋白系统,帮助理解其在细胞细胞间通讯所传递的信号语言。
7. 【综述】中山大学曾木圣教授:癌症诊断中的非编码RNA
Zeng M S. Noncoding RNAs in Cancer Diagnosis[M]//The Long and Short Non-coding RNAs in Cancer Biology. Springer Singapore, 2016: 391-427.
本文总结了人类几种常见癌症的诊断中所涉及的几种不同类型的非编码RNA。 其中包括外泌体中的miRNA、lncRNA等。
8. 【综述】阜外医院杨跃进教授改善干细胞治疗缺血性心脏病的新方法
Huang P, Tian X, Li Q, et al. New strategies for improving stem cell therapy in ischemic heart disease[J]. Heart Failure Reviews, 1-16. IF=3.611
该综述中包含各类细胞外泌体在干细胞治疗缺血性心脏病中的作用。
9. 【综述】中南大学湘雅医院&广西中医药大学第三附属医院:外泌体在肝癌中的重要作用
Wu, Z., et al. (2016). "Exosomes: small vesicles with big roles in hepatocellular carcinoma." Oncotarget. IF=5.008
10. 【综述】台北医科大学宋賢穎教授:肿瘤微环境中的外泌体作为互惠调节因子促进前列腺癌生长
Liu C M, Hsieh C L, Shen C N, et al. Exosomes from the tumor microenvironment as reciprocal regulators that enhance prostate cancer progression[J]. International Journal of Urology, 2016. IF=1.878
版权归外泌体之家所有,欢迎转载,但请注明出处和原文链接!
原文下载和讨论请点击:http://www.exosome.com.cn/forum.php?mod=viewthread&tid=1014&page=1&extra=&_dsign=e3370936
外泌体资讯网 国内外泌体领域进展(2016年7月)